La realidad es más sorprendente que la ficción
Margarita I. Bernal-U y Vivechana Agarwal
La Dra. Margarita I. Bernal Uruchurtu es Investigadora del Centro de Investigaciones Químicas de la Universidad Autónoma del Estado de Morelos (UAEMor) y es integrante de la Academia de Ciencias de Morelos.
La Dra. Vivechana Agarwal, es Investigadora del Centro de Investigación en Ingeniería y Ciencias Aplicadas (CIICAP) de la UAEMor. Su principal línea de investigación es el desarrollo de nanomateriales base silicio, carbono y metales nobles para su aplicación como estructuras fotónicas y/o sensado óptico.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
Este artículo está dedicado a nuestros estudiantes en el IICBA-UAEMor. Los futuros científicos especializados en nanoquímica, nanopartículas y sus propiedades.
Moungi G. Bawendi, Louis E. Brus y Alexei e I. Ekimov (Figura 1) recibieron el pasado jueves 5 de octubre una llamada muy temprano por la mañana. Los despertaron con la noticia de que los habían seleccionado como ganadores del premio de este año por el descubrimiento y síntesis de los puntos cuánticos.
En una época en la que el término cuántico se usa en la cultura popular de muchas formas y con gran frecuencia de manera gratuita o simplemente equivocada (¡Sí, tú Marvel! En ti y tu Quantummanía estoy pensando), el enterarnos que la Academia Sueca de Ciencias otorgó el Premio Nobel de Química 2023 a tres investigadores que están tras del descubrimiento y síntesis de los puntos cuánticos puede llevarnos a imaginar efectos especiales y retos difíciles de superar. Aquí queremos contarles un poco acerca de la aventura fantástica que es explorar el mundo nanoscópico, los efectos cuánticos que lo gobiernan y las importantes aplicaciones que la nanotecnología ha encontrado para los diminutos puntos cuánticos.

Figura 1. Imágenes del portal del Premio Nobel https://www.nobelprize.org
El mundo nano ¿qué es una nanopartícula?
Nano es el prefijo que utilizamos para designar una cantidad que es tan solo una millonésima parte de la milésima parte de una unidad de medición. Así, tenemos nanómetros, nanolitros, nanogramos, nanosegundos. Un nanómetro (nm) es entonces una millonésima parte de un milímetro (mm). Tome una regla o una cinta métrica con marcas cada mm e imagine dividir el espacio entre dos marcas en un millón de fragmentos iguales. Así se dará cuenta de la escala del mundo de las cosas más pequeñas que consideramos como materia: los átomos y las moléculas. Una molécula de agua, H2O, tiene un tamaño de apenas 0.3 nm aproximadamente. En la Figura 2 podrá familiarizarse un poco más con la diversidad de escalas correspondientes a diversos objetos.
Las nanopartículas se hallan entre las moléculas individuales y los materiales macroscópicos que forman. Su composición va desde decenas de átomos agrupados en geometrías bien definidas hasta miles de átomos formando estructuras con patrones regulares. Lo fascinante en las nano partículas (NP) es que sus propiedades son diferentes a las de un átomo o molécula aislada de la misma composición y a las del material en bulto.
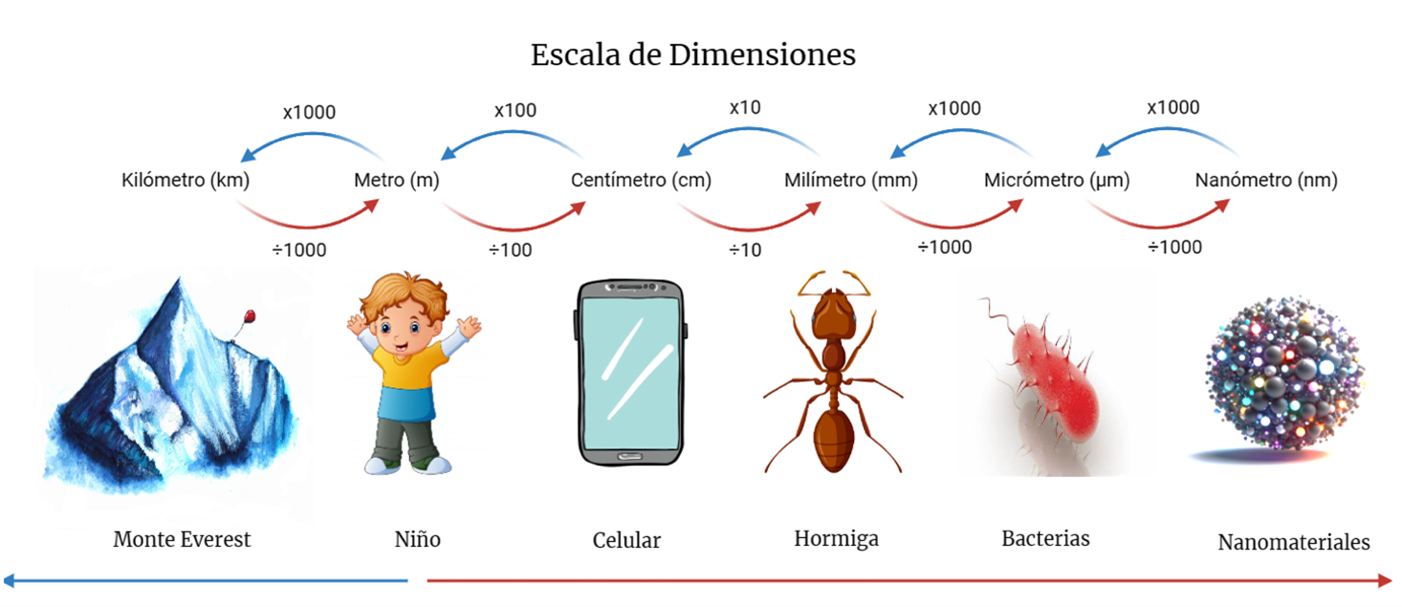
Figura 2. Algunos saltos en la escala de dimensiones.
¿Por qué el adjetivo cuántico?
La física y química cuántica son los campos que se ocupan de estudiar la intrincada relación entre materia y energía en escalas muy pequeñas describiendo con ello el comportamiento de los átomos y la luz. El mundo nanoscópico es la gran cancha de los efectos cuánticos. En las NP los fenómenos que tratamos de entender y sus aplicaciones son de origen cuántico. El mundo clásico, que incluye desde objetos que podemos observar con la ayuda de un microscopio óptico hasta grandes objetos que vemos a través de telescopios pasando por los objetos ordinarios que vemos a simple vista, obedece las leyes de la Física clásica, las conocidas leyes de Newton. En contraste, los objetos de tamaño nanoscópico no obedecen las leyes clásicas. Al inicio del siglo XX, se desarrolló un conjunto de nuevas leyes para explicar su comportamiento, la Teoría Cuántica de la Materia. Éstas conducen a fenómenos como la dualidad onda-partícula, la superposición de estados y el entrecruzamiento cuántico. A pesar de lo alejados que estos fenómenos se hallan de nuestra intuición, todos los experimentos que se han hecho para ponerlos a prueba los han confirmado. La física cuántica ha generado grandes avances tecnológicos que están en todas partes: láseres, transistores, relojes atómicos, instrumentos para imágenes médicas. Convivimos con aplicaciones de fenómenos cuánticos de manera cotidiana.
Richard Feynman, quien ganó el premio Nobel de Física en 1965 por sus contribuciones al campo de la electrodinámica cuántica, dijo: - “Hay mucho lugar en el fondo” refiriéndose a todo lo que aún hay que descubrir en el mundo nanoscópico. El artículo de Luis Mochán publicado la recientemente en esta misma columna cuenta otro aspecto de este fondo y lo que podemos aprender allí (ver Lecturas Recomendadas).
Redescubriendo algo viejo
Algunos grandes artesanos de la antigüedad (2000 A.C.) obtuvieron vidrio de colores mezclando cantidades muy pequeñas de algunos contaminantes en el crisol en donde fundían a muy alta temperatura la arena sílice (SiO2). Esos dopantes eran cantidades pequeñas de plata, oro u otros compuestos metálicos. Estos conocimientos también se usaron para preparar esmaltes que dan a las piezas cerámicas hermosos colores. Si bien no conocían la explicación del fenómeno observado, la experimentación y control de sus resultados resulta admirable. Los grandes maestros vidrieros sabían qué tipo de sales usar y en qué estados de oxidación para obtener tonalidades específicas: Azul-verde con cobre, violeta con cobalto, verde con cromo, ámbar con sulfuro de hierro y morado con manganeso.
El efecto de los dopantes también se observa en las piedras preciosas. Un ejemplo de esto son los rubíes: El óxido de aluminio es incoloro, pero si algunos átomos de aluminio son reemplazados por cromo, adopta colores que van desde el amarillo pálido hasta el rojo intenso. La sustitución de apenas unos pocos átomos, entre el 0.5 y el 2%, produce un cambio de color impresionante.
Desde el S. XIX los científicos comenzaron a estudiar cómo se comporta la luz y cómo los cristales coloreados pueden filtrar colores específicos. Al realizar experimentos con diversos vidrios se dieron cuenta que un solo dopante como el seleniuro de cadmio (CdSe) o el sulfuro de cadmio (CdS) podían conducir a cristales de diferentes colores dependiendo de las condiciones en las que los preparaban. En el siglo pasado, gracias a técnicas ópticas, fue posible confirmar que en los cristales coloreados había partículas muy pequeñas suspendidas.
La curiosidad y dedicación de los galardonados
Alexei Ekimov estaba fascinado por los vidrios de colores. Su curiosidad lo hacía preguntarse cómo era posible que una sola sustancia pudiera conducir a materiales de diferentes colores. En 1979 trabajando en el Instituto Estatal de Óptica Vasilov en Leningrado (ahora San Petersburgo) se propuso entender la composición química y la estructura de las partículas que, sin disolverse en el vidrio, le daban color. A esas partículas suspendidas se les conoce como partículas coloidales. Utilizando una forma de cloruro de cobre (CuCl), se dio cuenta de que la temperatura durante la fabricación del vidrio influye en el tamaño de las partículas coloidales, que iban desde 2 hasta 30 nm. Además, se percató que el vidrio formado absorbía luz de forma diferente dependiendo del tamaño de las partículas coloidales que quedaban atrapadas en éste. Las partículas más grandes absorbían luz de forma parecida al CuCl macroscópico, mientras que las más pequeñas la absorbían a frecuencias mayores, es decir, corridas hacia el azul de acuerdo con la distribución de colores en un arcoíris. Ekimov tuvo la brillante idea de explicar sus resultados como un efecto cuántico relacionado con el tamaño de las nanopartículas. Con técnicas de dispersión de rayos X pudo confirmar que el tamaño de los cristalitos de la sal de cobre suspendidos en el vidrio era nanométrico. Quizá ustedes se pregunten cómo se le ocurrió que se trataba de un efecto cuántico. En el trabajo previo de Ekimov en materiales semiconductores está la pista. En nano películas semiconductoras que había preparado antes, materiales tan delgados que se consideran de dos dimensiones, había observado que su interacción con la luz seguía el comportamiento de un problema que aparece comúnmente en los libros de texto de cuántica: el de un electrón atrapado en una región de la que no puede escapar. La solución de ese problema, conocida por todos los físicos lleva a que mientras más confinados están los electrones en las nanopartículas, más energía deben tener los fotones de la luz para ser absorbidos y luego emitidos. En la Figura 3 se muestra un esquema simplificado de este fenómeno. El corrimiento de los espectros de absorbancia y de emisión hacia al azul de las partículas suspendidas en el vidrio seguía ese mismo comportamiento. ¡Había descubierto los puntos cuánticos semiconductores! En 1981 publicó su descubrimiento, pero lo hizo en una revista soviética, la cual era de difícil acceso para investigadores que no leían en ruso o en cuyos países no era posible conseguir esa revista.
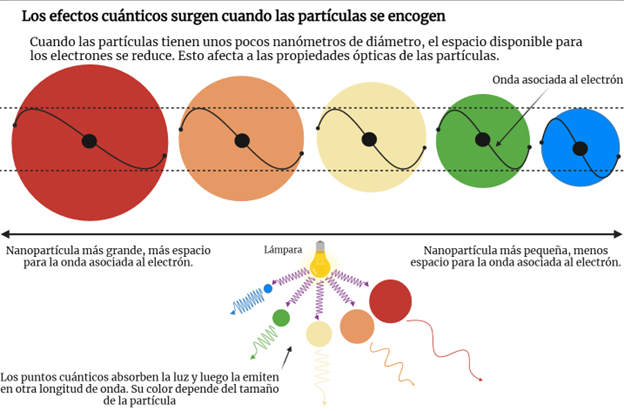
Figura 3. Los puntos cuánticos son nanopartículas que por su tamaño tienen una interacción especial con la luz. Recuerda que la respuesta óptica (luz absorbida y luz emitida) depende del tamaño de las partículas en las que el electrón está confinado. (Adaptado del trabajo de Johan Jarnestad @Nobelprize.org)
Éste fue el caso de Louis Brus y sus colaboradores, quienes sabían de los efectos cuánticos en materiales 2D, pero, no se habían enterado del descubrimiento de los puntos cuánticos semiconductores de Ekimov. Fue hasta 1984 cuando Louis Brus consiguió una traducción de los trabajos de Ekimov en Estados Unidos. A diferencia del soviético, el equipo dirigido por Brus estaba estudiando los coloides líquidos con partículas de otros metales como el cadmio, el zinc y el titanio. Buscaban preparar con ellos algunos fotocatalizadores útiles para la producción de materias primas de alto valor en síntesis química. Sin embargo, a lo que llegaron en 1983 fue al descubrimiento de los efectos de las partículas de CdS en medios líquidos. Ellos enfocaron su estudio en observar la evolución en el tiempo de las partículas suspendidas. Recién preparadas tenían un comportamiento que al día siguiente era diferente. Fueron capaces de explicar este cambio como el resultado de un aumento de tamaño de las partículas. Eran muchas y pequeñas recién preparadas, de aproximadamente 4.5 nm. Con el paso de las horas, se redisolvían para agruparse en partículas de mayor tamaño, cerca de 12.5 nm. Confirmaron así que el comportamiento de absorción de la luz estaba relacionado con el tamaño de la nanopartícula. Con la esperanza de comentar su trabajo con Ekimov y sus colaboradores, le envió copias de sus publicaciones y una carta celebrando que ambos estuvieran interesados en el mismo tema. La KGB, agencia de seguridad soviética, llamó a Ekimov y A. Efros, su más cercano colaborador, para interrogarlos acerca de su colaboración con un investigador en los Estados Unidos, pero ¡ni lo conocían! No fue sino hasta 1998, después de los cambios geopolíticos que acompañaron la caída de la Cortina de Hierro, que Efros y Ekimov pudieron conocer a Brus y establecer una colaboración con él.
Para que un descubrimiento pueda ser aprovechado es necesario que los resultados sean controlables, reproducibles, que satisfagan criterios de control de calidad. Ni los resultados de Ekimov ni los de Brus lo eran. Ellos lograron tener una distribución de tamaños de la que calcularon el tamaño promedio, pero su dependencia con la temperatura y la composición del medio en el que crecían era un asunto complejo de controlar. Moungi Bawendi, quien había trabajado con Brus y se instalaba como un nuevo profesor en el Instituto Tecnológico de Massachussets propuso a su grupo de estudiantes encontrar una forma de controlar el tamaño de las nanopartículas de CdS. Después de muchos ensayos, los estudiantes que realizaban su doctorado con él, Murray y Nirmal, encontraron un procedimiento químico muy ingenioso que los llevaba a obtener grandes cantidades de nanopartículas mono-dispersas, es decir, de un solo tamaño y estructura. Las muestras de mejor calidad se obtenían después de algunas horas de crecimiento constante. Para saber el tamaño de las partículas que se forman es necesario hacer experimentos ópticos, medir los espectros de absorción de luz. Ellos modularon la temperatura de crecimiento a partir de sus estimaciones de la distribución de tamaños. Al disminuir la temperatura el crecimiento se detiene. Para continuar el crecimiento es necesario aumentar nuevamente la temperatura. Con este procedimiento, una vez que el espectro de absorción confirmaba la presencia de partículas del tamaño deseado, una porción de la solución se extrajo del recipiente y se guardó para su uso posterior. De esta manera, fue posible obtener partículas desde 1.5 nm hasta 11.5 nm. Su método abrió la puerta a la aplicación en gran escala de los nanopuntos cuánticos. Bawendi fundó Lumicell, una compañía en Massachussets que fabrica puntos cuánticos para marcar e iluminar células cancerosas durante cirugías. Los estudiantes que se han formado en su grupo, inspirados por Brus y Bawendi, son ahora científicos trabajando en compañías dedicadas a la aplicación de los nanomateriales en diferentes campos.
¿Qué tan útil puede ser un punto y más si es cuántico?
Debido a la forma particular que tienen los puntos cuánticos para emitir luz, casi tres décadas después de su descubrimiento se han vuelto herramientas muy importantes en la nanotecnología y forman parte de objetos de uso cotidiano. Al absorber luz azul, los puntos cuánticos emiten luz verde o roja, dependiendo de su tamaño. Los utilizamos en las pantallas de computadoras y de TV que funcionan con tecnología QLED (Q- de quantum dot, su nombre en inglés). En estas pantallas se produce luz azul empleando diodos que consumen muy poca energía (cuyo desarrollo mereció el Premio Nobel de Física en 2014) y los puntos cuánticos se utilizan para cambiar una parte de ésta por luz roja o verde. Así se cuenta con los tres colores básicos necesarios para la creación de imágenes de colores. Los puntos cuánticos también se utilizan en algunas lámparas LED para cambiar la luz blanca y fría en luz cálida con tonalidades amarillas. La emisión de luz de los puntos cuánticos también ha sido utilizada en bioquímica y medicina mediante pares molécula-nanopartícula. La molécula que participa en algún proceso bioquímico puede activar la emisión de luz del punto cuántico, ayudando a identificar el órgano o el tejido en el que esta molécula es utilizada. Los médicos están muy interesados en utilizar este nanodispositivo para poder seguir los procesos neoplásicos, migración de las células cancerosas en el cuerpo. En química, además del uso de los puntos cuánticos para activar algunas reacciones químicas, han sido utilizados para detectar contaminantes en agua. Éstas son apenas algunas de las fantásticas aplicaciones que se han desarrollado en un periodo relativamente corto. Apenas iniciamos la comprensión de cuánto se puede hacer con puntos cuánticos.
Hay algunos grupos de científicos y tecnólogos que prevén un uso futuro en dispositivos electrónicos flexibles, sensores muy pequeños capaces de detectar cantidades minúsculas de alguna substancia, celdas solares muy delgadas y también aplicaciones en el campo del encriptamiento y la seguridad de las comunicaciones. Si somos lo suficientemente curiosos, el nanomundo tiene numerosas aventuras maravillosas esperando ser descubiertas. En la Figura 4 encontrarás algunas aplicaciones de puntos cuánticos que han sido desarrolladas.
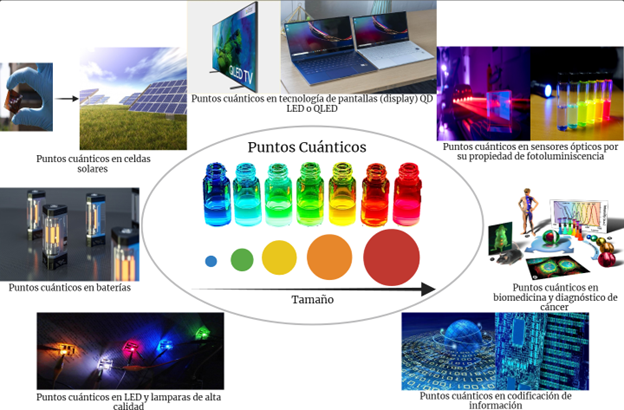
Figura 4. Algunas aplicaciones de puntos cuánticos
Sin duda, la producción de nano puntos cuánticos ha adquirido importancia económica. Hace apenas dos años, su mercado mundial era de 4,000 millones de dólares. Se predice un crecimiento anual del 16.2% anual durante cinco años, con lo que en 2026 su mercado alcanzará valores cercanos a los 8,600 millones de dólares. El destino principal de los puntos cuánticos sigue siendo la fabricación de pantallas de gran tamaño y alta resolución. Entre las ventajas que destacan de esta nueva tecnología es la posibilidad de tener dispositivos muy ligeros y con un consumo eléctrico bastante menor que el de tecnologías anteriores.
Hasta ahora los principales fabricantes de estas nanopartículas se encuentran en Corea del Sur, Estados Unidos, Reino Unido, Japón y Alemania. Sin embargo, hay un área de enorme oportunidad para la siguiente generación de nanopartículas con propiedades cuánticas.
La meta ha cambiado: Baja toxicidad sin comprometer la eficiencia
El cadmio (Cd) es un metal muy tóxico para los seres vivos. Por tal razón, muchos grupos de científicos dedican sus esfuerzos a encontrar puntos cuánticos libres de Cd. Esto los haría sostenibles y aptos para aplicaciones biológicas. El uso de metales como el Cd y las tierras raras ha sido probado con gran éxito, pero también con enorme preocupación por lo escaso y costoso de las materias primas. El reto actual es preparar nanopuntos de otros materiales abundantes y que sean compatibles con aplicaciones biomédicas. Las perovskitas de haluro de plomo y cesio fueron la primera tecnología de puntos cuánticos sin cadmio. Sin embargo, su poca accesibilidad comercial derivada de su alto costo de producción obliga a explorar otras posibilidades. Se buscan alternativas amigables con el medio ambiente y cuya producción sea barata, rápida, eficaz y eficiente. Estas características han llevado a muchos grupos a voltear su mirada hacia la síntesis y estudio de puntos cuánticos de carbono utilizando precursores de carbono como biomasa y/o moléculas orgánicas. En el CIICAp de la UAEM, el grupo de la Dra. Agarwal ha logrado producir nanopuntos de carbono por esta vía. El camino está preparado. Se necesitan más científicos con una formación en el área de nanoquímica y nanotecnologías que se aventuren en el descubrimiento de propiedades útiles y su aprovechamiento en el diseño de las posibles aplicaciones.
Referencias
- A.I. Ekimov, A.A. Onushchenko, V.A. Tsekhomskii, Fiz. Khim. Stekla 6 (1980) 511. 265
- R. Rosetti, L. Brus, J. Phys. Chem. 86 (1982) 4470
- C B Murray, D J Norris, M.G. Bawendi, J. Am. Chem. Soc., 115 (1993), 8706-8715
Lecturas recomendadas
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos. Desde la Academia de Ciencias de Morelos externamos nuestra preocupación por el vacío que genera la extinción de la Secretaría de Innovación, Ciencia y Tecnología dentro del ecosistema de innovación estatal que se debilita sin la participación del Gobierno del Estado.











 Desarrollado por Linabat
Desarrollado por Linabat