La carrera hacia la vacuna contra COVID-19 (Segunda Parte)
F. Alejandro Sánchez Flores
Miembro de la Academia de Ciencias de Morelos
La carrera para obtener una vacuna contra la actual pandemia de COVID-19, sigue siendo un proceso donde el compromiso científico y médico es muy importante. El mundo sigue en la expectativa de una solución al problema más grande de salud que ha habido en los últimos 100 años. El camino para desarrollar una vacuna, ha sido más corto que para otras enfermedades, pero no deja de ser complicado y lleno de obstáculos que hay que sortear por el bien de la humanidad. En esta entrega, continúo con la revisión de los resultados de otras vacunas basadas en diferentes estrategias. También abordo el tema de la importancia de las fases clínicas y la ética durante el desarrollo de una vacuna.
La vacuna de Sinopharm y el Instituto de Productos Biologicos de Wuhan
Esta vacuna se basa en utilizar la cepa WIV04 del virus SARS-CoV-2, la cual se aisló de un paciente que estuvo en el hospital Jinyintan en Wuhan. El virus se cultiva en células de riñón de mono verde, lo cual es una técnica común de laboratorio y se inactiva para después ser mezclada con alumbre (hidróxido de aluminio), el cual funciona como adyuvante en la vacuna. Esta vacuna se administra vía intramuscular en una inyección de 0.5 ml y fue aplicada a 96 pacientes durante la fase 1 y a 224 pacientes en la fase 2, donde los participantes eran adultos entre 18 y 59 años con una tasa de 60/40% de mujeres/hombres. Cabe mencionar que inicialmente para la fase 1, se habían reclutado 201 voluntarios, pero 105 fueron descartados y en la fase 2 se habían reclutado 280 de los cuales 56 también fueron descartados (Figura 1). Las razones para descartarlos fueron padecer comorbilidades, no haber llenado el formato de consentimiento, tener reacciones alérgicas a medicamentos, resultados anormales en los análisis clínicos o por haber estado en áreas con riesgo de contagio al virus.
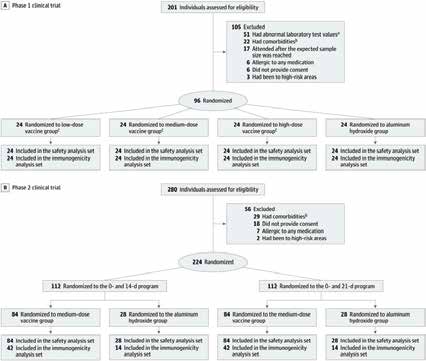
Figura 1. Diseño experimental del estudio para la vacuna del virus inactivado, para las fases 1 y 2. Se detalla la distribución de los participantes para cada grupo. Tomada de: https://jamanetwork.com/journals/jama/fullarticle/2769612
Para la fase 1, se hicieron 3 grupos de manera aleatoria, donde se probaron 3 diferentes dosis de la vacuna (baja, media, alta) y un grupo control donde solo se les administra adyuvante (alumbre). La vía de administración fue intramuscular y se aplicó la inyección inicial, a los 28 y a los 56 días. Para la fase 2, ya con la dosis definida, los 224 participantes fueron divididos en 2 grupos para probar la inmunidad generada por la vacuna (Figura 1) a los 14 y 21 días. En ambas fases clínicas, los pacientes fueron inyectados 3 veces ya sea con solo el adyuvante o una dosis de la vacuna. Es importante mencionar que, en todos los casos hubo siempre un grupo control donde solo se administró el adyuvante (alumbre) y que no se espera que genere una respuesta inmune contra el virus. Esto nos permite distinguir si la vacuna tiene un efecto real o si el efecto placebo no es distinguible de la vacuna. Se revisaron a todos los pacientes para evaluar las complicaciones y reacciones adversas que pudieran ser relacionadas con la vacuna y para la fase 1, se registró que el 12.5% de los pacientes que recibieron solo el adyuvante, presentaron algún tipo de reacción. Para las 3 diferentes dosis, se observó que el 20.8%, 16.7% y 25.0% de los pacientes, presentaron reacciones para las dosis baja, media y alta, respectivamente. Por lo tanto, para la fase 2, se decidió que se usaría la dosis media, para la cual se evaluaría la respuesta inmune a los 14 o 21 días. Para el grupo de 14 días, los que recibieron solo el adyuvante o la vacuna, el 6 y 14.3% de los pacientes presentaron alguna reacción adversa, respectivamente. En el caso del grupo de 21 días, presentaron reacciones adversas el 19 y 17.9%, con la vacuna o solo el adyuvante, respectivamente. Dentro de las reacciones adversas más comunes se observaron dolor en el sitio de la inyección y fiebre, las cuales fueron catalogadas como leves.
Tomando muestras de sangre de los pacientes que recibieron la vacuna, se evaluó la cantidad de anticuerpos neutralizantes, para cada tratamiento en ambas fases. En resumen, todos los que recibieron la vacuna presentaron anticuerpos capaces de unirse a la proteína de la espiga, con lo que serían capaz de neutralizar al virus de manera específica vía inmunoglobulinas tipo G (IgG). Algo importante es que la cantidad y efectividad de la vacuna aumenta con el número de aplicaciones y el tiempo. Por lo que a los 28 días y después de 3 inyecciones, se obtuvieron los mejores resultados. En comparación con los resultados obtenidos con la vacuna de AstraZeneca y otras vacunas, los resultados de anticuerpos neutralizantes fueron muy similares. También se revisó que no hubiera reacción inmune en los pacientes que recibieron solo el adyuvante. Sin embargo, no se observó ninguna reacción que fuera de preocupación, aunque se seguirá monitoreando en la subsecuente fase 3.
Los autores que reportan los resultados de esta vacuna, declaran las limitaciones que tiene tanto su estudio como el alcance de la vacuna. La planeación de las pruebas tuvo que cambiar sobre la marcha, por lo que por lo que algunos resultados deben ser interpretados con cuidado. Solo se presentaron resultados para algunos de los grupos probados en las reacciones adversas, por lo que analizar un número mas grande de casos incrementara la confiabilidad estadística a todos los niveles. Finalmente, a pesar de la generación de anticuerpos neutralizantes, no se puede asegurar que dichos anticuerpos puedan proteger de una infección por SARS-CoV-2 aunque las probabilidades son altas.
La vacuna Gam-Covid-Vac (Sputnik V) del Instituto de Investigación Gamaleya
Esta vacuna desarrollada por uno de los institutos de investigación del gobierno ruso, ha generado una gran controversia en la comunidad científica y en la sociedad. La razón fue que el presidente de Rusia, Vladimir Putin, realizó una declaración el 11 de agosto donde renombra la vacuna a Sputnik V y que iniciarían la producción y aplicación de la vacuna, antes de tener los resultados de la fase 3. Sin embargo, unos días después se retractaron y dijeron que solo se usaría la vacuna hasta que tuvieran la aprobación después de revisar los resultados de la fase 3. Esta fase pretende reclutar cerca de 40,000 participantes en diferentes países, entre los cuales se encuentra México.
La estrategia para esta vacuna fue usar dos adenovirus recombinantes en los cuales se pone la información genética para la proteína completa de la espiga del virus SARS-CoV-2 (rAd26-S y rAd5-S). De manera similar a la vacuna de AstraZeneca, estos vectores virales no se pueden replicar en el cuerpo humano, por lo que hay que poner una dosis alta de 1 trillón de estas partículas virales por dosis. Aquí puede venir la primera critica, ya que dicha dosis está basada en resultados no publicados de su fase preclínica, por lo tanto dicho estudio no ha sido evaluado por otros miembros de la comunidad científica de manera independiente. El diseño para la fase 1 y 2 de esta vacuna, es diferente a los que se ha visto para las otras vacunas (Figura 2). De entrada, se evaluaron los efectos de cada vector viral por separado y luego en conjunto de manera consecutiva. Se aplicó de manera intramuscular, ya sea a partir de la vacuna congelada o liofilizada (en polvo), reconstituida en agua. Para la fase 1, se aplicó una sola dosis donde en un grupo se probó el vector rAd5-S y en otro el vector rAd26-S, ambos por separado y se evaluó la respuesta a los 28 días. Para la fase 2, se administró una primera dosis del vector rAd26-S y una segunda dosis del vector rAd5-S a los 21 días, donde se evaluaron los resultados. Otra crítica es que los participantes no fueron organizados en los grupos de manera aleatoria, sino que fueron incluidos simplemente en cuanto su consentimiento firmado era recibido. Esto puede generar sesgos, como la distribución de género en grupos donde se tuvieron solo hombres para el estudio. Finalmente, la respuesta inmune de cada participante fue evaluada a los 0 y 28 días para los de la fase 1 y 0, 28 y 42 días para los de la fase 2.
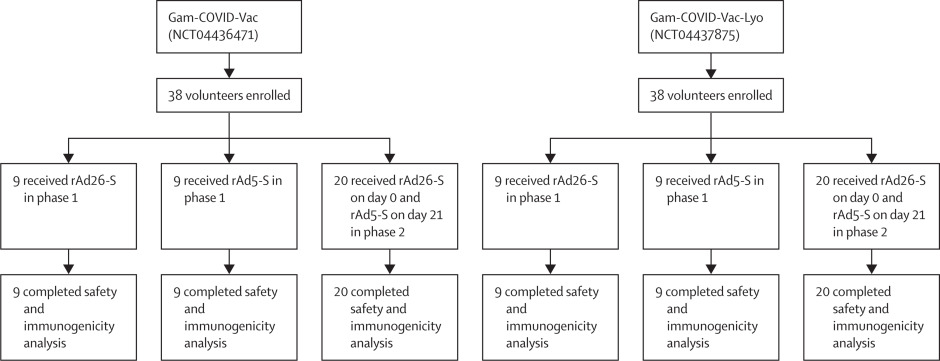
Figura 2. Diseño experimental para la vacuna Gam-Covid-Vac (Sputnik V) para las fases 1 y 2. Tomada de: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31866-3/fulltext
Los resultados obtenidos para esta vacuna en el día 14, ya sea con alguno de los dos virus recombinantes por separado, se observaron anticuerpos IgG específicos para el dominio de unión de la proteína espiga del SARS-CoV-2, en el 88.9% de los pacientes que recibieron el vector rAd26-S y el 84.2% los que recibieron el rAd5-S. Sin embargo, a partir del día 21, el 100% de los participantes presentaron los anticuerpos. Durante la fase 2, el 85% de los participantes presentaron los IgG después del día 14 después de la primera dosis con el vector rAd26-S, pero el 100% de participantes desarrollaron los anticuerpos a partir del día 21. El refuerzo con el vector rAd5-S dio como resultado que la cantidad de anticuerpos IgG se incrementaran en comparación con los generados con solo un vector, lo cual se observó después de 7 días de administración del refuerzo. Un resultado importante es que, al cabo de 42 días, solamente el uso de los 2 vectores virales pudo generar la generación de anticuerpos en el 100% de los participantes, lo cual no se alcanza si se usa alguna de las vacunas por separado. Se realizaron pruebas para otros mecanismos del sistema inmune como los linfocitos tipo T, para los cuales se observaron resultados similares a los reportados por otras vacunas basadas en vectores virales. A pesar de que los resultados obtenidos son muy prometedores, hay detalles en el diseño experimental que generan cierta alarma. Por ejemplo, no usan un control negativo como los vectores virales con otra proteína que no tenga que ver con el virus, como lo hacen en la vacuna de AstraZeneca. También, el número de participantes por grupo es muy pequeño, comparado con los estudios de las otras vacunas y esto puede hacer cuestionables los resultados del estudio.
Finalmente, lo más cuestionable el desarrollo de esta vacuna, es que el gobierno ruso quisiera aplicarla en la población, antes de tener los resultados de una fase clínica 3, lo cual puede ser sumamente peligroso para los participantes.
La importancia de la fase 3 y la ética
En la fase 3, la vacuna se administra a miles de personas donde ya se incluyen participantes de diferentes edades, incluyendo algunos con enfermedades que los ponen en grupos de riesgo. Todo esto se debe comparar contra un grupo donde se administra un placebo, el cual no debe generar una respuesta inmune contra el virus y todo en un esquema donde los voluntarios no saben si están recibiendo la vacuna o el placebo. Básicamente, esta etapa determina si la vacuna va a generar una protección en caso de una infección real por el virus. En junio, la Federal Drug Andministration (FDA) de Estados Unidos determinó que, para dicho país, cualquier vacuna que se autorice para su uso debe conferir al menos una protección del 50% de la población vacunada, para ser considerada como una vacuna efectiva. Por otro lado, en esta fase se llegan a observar casos con reacciones adversas graves que posiblemente no se observaron en las otras fases, debido al número limitado de participantes.
En la entrega anterior publicada el pasado 6 de septiembre, se describieron los resultados de la vacuna desarrollada por la Universidad de Oxford y la compañía AstraZeneca. Muy recientemente, la compañía anunció que detendrían el desarrollo de la vacuna, debido a que uno de los participantes de la fase 3. A pesar de que la suspensión del proyecto solo duró 6 días, el hecho de investigar cualquier problema relacionado con la vacuna, aunque fuera solo por un caso, habla muy bien de la seriedad y sentido de la ética de la empresa y desarrolladores involucrados. Si bien la farmacéutica no dio detalles del caso, algunas fuentes cercanas pero extraoficiales, relataron que el uno de los participantes presentó una enfermedad inflamatoria llamada mielitis transversa. Esta enfermedad se da la inflamación en ambos lados de la parte baja de la columna vertebral. Síntomas como dolor, debilidad muscular, parálisis y perdida de las funciones en la vejiga e intestinos, son relacionados con este padecimiento. Debido a que esta enfermedad puede estar relacionada a infecciones virales o alteraciones del sistema inmune, se tuvo que suspender la fase 3 de la vacuna hasta no tener mayores evidencias o reportes de este caso. Después de ser evaluado el caso por un comité de las autoridades regulatorias de medicamentos, la fase 3 de la vacuna ChAdOx1 continua su camino a partir del 12 de septiembre, aunque solo dentro del Reino Unido, lo cual generó ciertas especulaciones.
A nivel mundial, es importante demostrar una ética intachable durante el desarrollo de una vacuna y más si involucra el tratamiento que podría terminar con una pandemia. Si algo sale mal, entonces la salud de la población mundial se podría ver comprometida, no solo por los efectos secundarios de la aplicación de la vacuna, sino por una fallida protección de la vacuna contra el SARS-CoV-2. En ese aspecto, las políticas de algunos de los desarrollos en países como China y Rusia han sido muy cuestionados. En ambos países, se han autorizado el uso de vacunas sin tener los resultados de la fase 3. Este es el caso de la vacuna china de la compañía CanSinoBIO basada en el adenovirus llamado Ad5 (similar al de la vacuna rusa), donde a partir del 25 de junio la vacuna se ha administrado al personal militar en China.
En el caso de la vacuna rusa que ha sido revisada en esta publicación, las declaraciones iniciales sobre su autorización sin esperar a los resultados de la fase 3, han generado críticas importantes que podrían tener consecuencias a largo plazo. Incluso, en México se ha llegado a acuerdos para realizar parte de los ensayos clínicos de la fase 3 para la vacuna Sputnik V, pero se han generado críticas y cuestionamientos a raíz de esta decisión, los cuales en parte se originan debido a los resultados de las pruebas de las fases 1 y 2, pero en gran medida por el manejo político que se le ha dado.
Finalmente, se han revisado los desarrollos más importantes de vacunas contra COVID-19, en función de los resultados reportados y su grado de avance. Sin embargo, como podemos ver, ninguno esta libre de critica y cuestionamiento ya sea por la comunidad científica o por la sociedad en general. En la medida que los resultados de la fase 3 garanticen la efectividad y seguridad de dichas vacunas, tendremos al menos 3 opciones para el 2021 que nos ayuden a controlar la actual pandemia. No hay que olvidar, que la efectividad de estas vacunas esta también relacionada con otros factores como la mutabilidad del virus la cual, aunque ha demostrada ser baja, sigue siendo un riesgo latente. Hay que considerar que un buen programa de vacunación en cada país, será necesario para erradicar la enfermedad a nivel mundial. Por lo mientras, las medidas de higiene y que posiblemente un aislamiento intermitente, serán medidas necesarias para el control de la enfermedad, al menos hasta que las vacunas sean aprobadas, producidas y aplicadas a nivel mundial.
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos. Desde la Academia de Ciencias de Morelos externamos nuestra preocupación por el vacío que genera la extinción de la Secretaría de Innovación, Ciencia y Tecnología dentro del ecosistema de innovación estatal que se debilita sin la participación del Gobierno del Estado.
Referencias
https://jamanetwork.com/journals/jama/fullarticle/2769612
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31866-3/fulltext
Ligas de interés
https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html
https://www.nytimes.com/2020/09/12/health/astrazeneca-coronavirus-vaccine-trial-resumes.html








 Desarrollado por Linabat
Desarrollado por Linabat