El huevo o la gallina: ¿Aplicación de la ciencia o ciencia aplicada? (Primera Parte)
F. Alejandro Sánchez Flores
Instituto de Biotecnología, UNAM
Miembro de la Academia de Ciencias de Morelos
Seguramente hemos escuchado más de una vez la frase “¿Que fue primero, el huevo o la gallina?”, que hace referencia a un dilema filosófico relativo al origen de algo, pero que a su vez plantea una falacia de tipo circular. Esto puede ser aplicado a cualquier problema donde existen ciclos. Replanteado de otra manera, la frase nos permite preguntarnos: “¿Qué es primero, X que no puede existir sin Y o Y que no puede existir sin X?”. Podemos divagar preguntándonos que dio origen a que, en el caso del huevo y la gallina, pero quisiera aprovechar esta conocida frase para hacer referencia a un problema similar que hoy en día tenemos en la percepción de la ciencia y su utilidad.
Desde hace siglos, existe un debate entre la división entre ciencia básica (o pura) y ciencia aplicada. Esta clasificación o división podría parecer sensata desde el punto de vista de la Economía o para los directivos de alguna institución gubernamental donde se trate de justificar el financiamiento de una o la otra. Sin embargo, la historia nos demuestra que para la ciencia en sí, esta clasificación no tiene mucho sentido y aunque existen diferencia entre una y la otra, es solo una división utilitaria. A continuación, haré referencia a algunos ejemplos de descubrimientos fueron mérito de investigación que se puede catalogar como ciencia básica pero que con el tiempo, la inversión y la visión necesaria, se convirtieron en aplicaciones que cambiaron y siguen cambiando (y salvando) la vida de muchas personas. Además de describir de la parte científica de cada descubrimiento, trataré de hacer una reflexión del contexto y circunstancias en las que fueron realizados, en donde influyó el azar o la serendipia, pero sobre todo un gran poder de observación e inteligencia.
En las siguientes tres entregas hablaremos del descubrimiento de la penicilina y la terapia de “fagos” (primera parte); las vacunas (segunda parte) y; el desarrollo de antivenenos (tercera parte). En la tercera y última entrega, hablaremos de como la ciencia nos puede ayudar a resolver el dilema del huevo y la gallina.
Fleming y sus descubrimientos
El científico británico Alexander Fleming, era un médico microbiólogo que trabajaba en el hospital St. May en Londres, Inglaterra. Trabajando en el “Departamento de Inoculaciones” de este hospital, donde se realizaba investigación orientada a la fabricación y mejora de vacunas, tratamientos y sueros, Fleming se dedicaba a la investigación de nuevos tratamientos contra infecciones bacterianas. Sin embargo, durante la Primera Guerra Mundial (1914-1918) fue reclutado como medico militar en los frentes de Francia, donde observó de primera mano la gran mortalidad causada por heridas de bala que se infectaban. En el mejor de los casos, las heridas terminaban en gangrena y amputación de la extremidad afectada. Al terminar la guerra, se dedicó a buscar sustancias antisépticas que pudieran ayudar a evitar la agonía provocada de estas heridas.
Uno de los primeros descubrimientos de Fleming (1922), fue una proteína llamada lisozima que debilita a las bacterias ya que altera su pared celular. Curiosamente, este descubrimiento fue producto de un accidente, donde un estornudo sobre una caja de Petri donde crecían bacterias, reveló algo inesperado. Algunos días después, Fleming notó que las bacterias que habían recibido el flujo nasal, fueron destruidas. Hoy en día sabemos que la lisozima es producida por diferentes mucosidades en nuestro cuerpo y la podemos encontrar en la saliva, moco y lágrimas. También es abundante en la leche humana, en la clara del huevo y en células del sistema inmune como los neutrófilos. La investigación acerca de esta enzima, fue continuada por muchos otros científicos que han descubierto su rol en el sistema inmune, su relación con enfermedades genéticas que involucran deformaciones en los huesos o incluso, aplicaciones industriales como su uso para control de bacterias lácticas en los vinos o evitar la contaminación en quesos por bacterias del género Clostridium.
Sin discusión, el descubrimiento más importante de Fleming fue la penicilina (Figura 1). A finales de julio de 1928 cuando Fleming estaba por irse de vacaciones, dejo unas 50 cajas de Petri donde crecía a la bacteria patógena Staphylococcus aureus. Al regresar en septiembre del mismo año, encontró cajas contaminadas por un hongo o moho, similar al que le crece al pan. Fleming observó las placas y comprobó que las colonias bacterianas que se encontraban alrededor del hongo (más tarde identificado como Penicillium notatum) eran transparentes debido a una lisis o destrucción de las bacterias. El científico comunicó su descubrimiento sobre esta sustancia, la cual bautizó como penicilina, en el British Journal of Experimental Pathology en 1929.
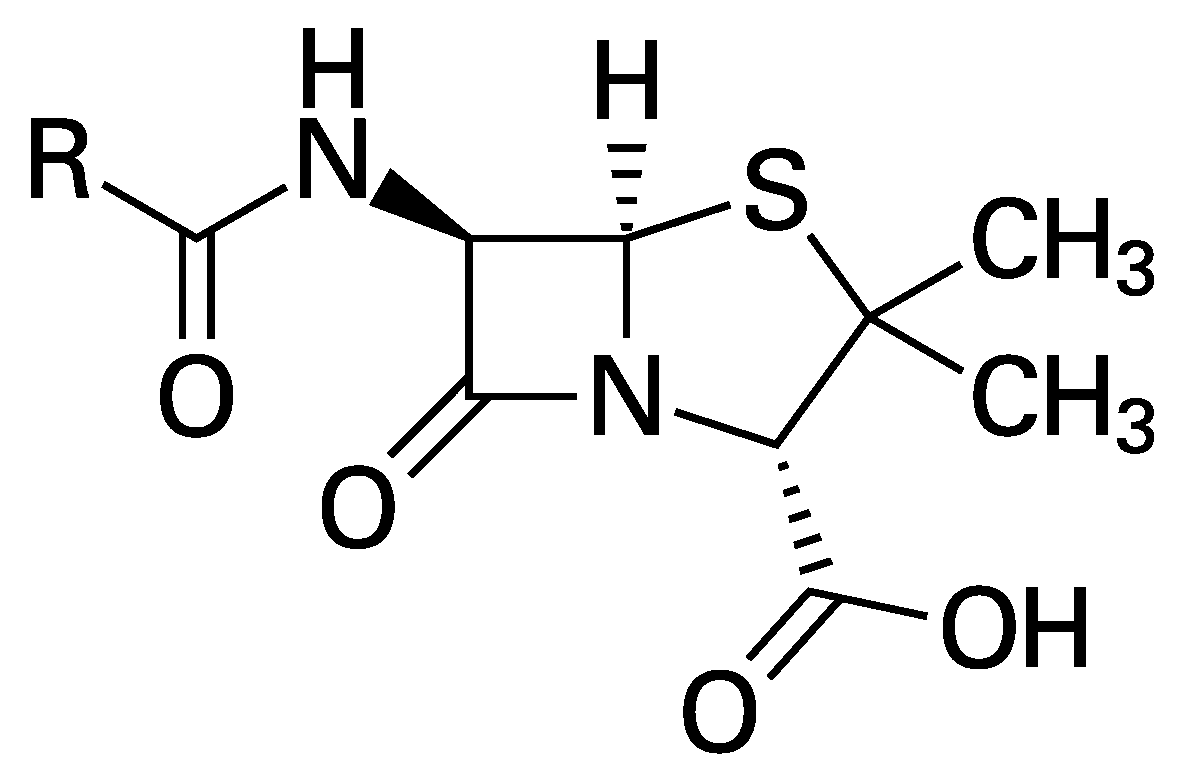 Figura 1. Estructura de la penicilina. Tomada de https://es.wikipedia.org/wiki/Penicilina
Figura 1. Estructura de la penicilina. Tomada de https://es.wikipedia.org/wiki/Penicilina
La era de los antibióticos, la revolución médica y la Segunda Guerra Mundial
En este columna, ya se ha hablando detalladamente de los antibióticos (http://www.acmor.org.mx/?q=content/antibi%C3%B3ticos-mol%C3%A9culas-que-curan). Sin embargo, aquí hablaremos de la parte más histórica, cubriendo la misma historia desde otro ángulo.
Fleming trabajó con el hongo durante un tiempo, pero la obtención y purificación de la penicilina a partir de los cultivos de Penicillium notatum resultaron difíciles. La comunidad científica creyó que la penicilina sólo sería útil para tratar infecciones banales y por ello no le prestaron atención. Fleming abandonó sus trabajos entre 1929 y 1931 porque pensó que la penicilina no podría servir para tratar una infección. Sin embargo, fueron el médico australiano Howard Walter Florey y el bioquímico alemán Ernst Boris Chain, quienes retomaron el trabajo de Fleming e iniciaron una investigación detallada y sistemática de los antibióticos naturales.
A principios de los años treinta, Florey comenzó a estudiar la lisozima (descubierta por Alexander Fleming en 1922). A finales de la década (1939), en colaboración con Ernst Chain logró aislar el principio activo que producía el hongo (la penicilina) y que Fleming no había logrado aislar por falta de recursos económicos. En 1940, de manera paralela Norman George Heatley comenzó pruebas en ratones, para usar la penicilina para combatir enfermedades de origen bacteriano. Fue el quien desarrolló un método de extracción mas eficiente para purificar la penicilina. En 1941, Florey y Heatley quienes trabajaban en la Universidad de Oxford en ese entonces, viajaron a Estados Unidos para persuadir a un laboratorio en Pretoria, Illinois, para producir masivamente la penicilina. Habiendo obtenido penicilina en cantidades suficientes, se comenzaron a probar sus efectos en nueve pacientes. Los resultados fueron satisfactorios, quedando demostrados los efectos terapéuticos de la penicilina inyectada en humanos. La producción industrial se iniciaría en 1943, permitiendo el tratamiento de los heridos de la Segunda Guerra Mundial, donde se hizo evidente su valor terapéutico y fue un factor para que el bando de los Aliados ganase la guerra. Desde entonces, se ha utilizado con gran eficacia en el tratamiento contra gran número de gérmenes infecciosos, entre ellos los relacionados con enfermedades como la gonorrea y la sífilis. Después de superar los ensayos clínicos en humanos, Florey, Chain y Fleming recibieron el premio Nobel de Medicina en 1945 por este gran descubrimiento (Figura 2).

Figura 2. Ganadores del premio Novel por el descubrimiento de la penicilina. Tomada de https://www.philpoteducation.com/mod/book/view.php?id=832&chapterid=2867#/
Cabe mencionar, que Heatley fue excluido de dicho galardón y poco se menciona de su participación en el descubrimiento de la penicilina. Mientras que Florey regresó a Inglaterra para continuar con la investigación, Heatley permaneció en Pretoria trabajando con el Dr. Andrew J. Moyer, con quien trabajó para incrementar los rendimientos de penicilina. Permaneció un tiempo mas en Estados Unidos trabajando en la compañía farmacéutica Merck, para volver en 1942 a Oxford, Inglaterra. Para su sorpresa, Moyer publicó los resultados del trabajo que ambos habían desarrollado, sin darle crédito a Heatly. Las razones que motivaron a Moyer a excluir a Heatly de las publicaciones, fueron la avaricia principalmente. A pesar de existir un convenio legal donde se estipulaba que ambos deberían ser reconocidos como autores, le pareció fácil excluir a Heatly para simplificar los trámites de patentes, quedando el cómo el único inventor del proceso de producción de la penicilina. Sin excusa alguna, esto fue un comportamiento carente de ética profesional.
Si hacemos las cuentas, este descubrimiento revolucionario que cambió el rumbo de la historia y ha aumentado la esperanza de vida de la humanidad, tuvo un proceso de casi 30 años. Definitivamente por la mente de Fleming no paso la pregunta: “¿Cuál podría ser la aplicación de este hongo en la industria?” (ciencia aplicada) sino posiblemente haya sido: “¿Como es que este hongo, produce algo que puede matar bacterias?” (ciencia básica). La generación del conocimiento científico no siempre puede tener una aplicación que cambie al mundo, pero puede ser cuestión de tiempo, esfuerzo, dinero y la participación de otros investigadores para encontrar una aplicación.
La resistencia a los antibióticos y la búsqueda de nuevas terapias
Quien iba a pensar que el inicio de la era de los antibióticos iban a propiciar un problema que actualmente resulta alarmante. Cabe mencionar que desde 1940, cuando los científicos Abraham y Chain aislaron y caracterizaron una enzima en Escherichia coli que es capaz de romper la molécula de penicilina, se han descrito muchos otros mecanismos de resistencia a los antibióticos que constituyen una respuesta de adaptación al ambiente adverso que representa un tratamiento antimicrobiano. Ha sido solo cuestión de tiempo para que el resultado del uso de antibióticos, sea la selección de bacterias multirresistentes para las cuales no existirán tratamientos que pueda eliminarlas. La Organización Mundial de la Salud publicó en el año 2017, una lista de 12 familias de bacterias patógenas, que requieren de atención, debido al desarrollo de resistencia hacia los antibióticos. La lista en orden de prioridad es la siguiente:
Prioridad 1: CRÍTICA
Acinetobacter baumannii, resistente a los carbapenémicos
Pseudomonas aeruginosa, resistente a los carbapenémicos
Enterobacteriaceae, resistentes a los carbapenémicos, productoras de ESBL
Prioridad 2: ELEVADA
Enterococcus faecium, resistente a la vancomicina
Staphylococcus aureus, resistente a la meticilina, con sensibilidad intermedia y resistencia a la vancomicina
Helicobacter pylori, resistente a la claritromicina
Campylobacter spp., resistente a las fluoroquinolonas
Salmonellae, resistentes a las fluoroquinolonas
Neisseria gonorrhoeae, resistente a la cefalosporina, resistente a las fluoroquinolonas
Prioridad 3: MEDIA
Streptococcus pneumoniae, sin sensibilidad a la penicilina
Haemophilus influenzae, resistente a la ampicilina
Shigella spp., resistente a las fluoroquinolonas
El grupo de prioridad crítica incluye a las bacterias multirresistentes que son especialmente peligrosas en hospitales, residencias de ancianos y entre los pacientes que necesitan ser atendidos con dispositivos como ventiladores y catéteres intravenosos. Son bacterias que pueden provocar infecciones graves y a menudo mortales, como septicemias y neumonías. Estas bacterias han adquirido resistencia a un elevado número de antibióticos, como los carbapenémicos y las cefalosporinas de tercera generación, que son los mejores antibióticos disponibles para tratar las bacterias multirresistentes.
Los niveles segundo y tercero de la lista (categorías de prioridad alta y media) incluyen otras bacterias que exhiben una farmacorresistencia creciente y que provocan enfermedades comunes como la gonorrea o enfermedades gastrointestinales como la salmonelosis. Los tres grupos además de generar una preocupación mundial, deben orientar el desarrollo de nuevas estrategias de combate, que requerirán de la aplicación del conocimiento científico existente y orientar el esfuerzo de nuevas investigaciones para resolver el problema.
La historia de una berenjena podrida y el desarrollo de la terapia de “fagos”
En 2010, una estudiante de licenciatura en Durban, Sudáfrica, se encontraba raspando el lodo de la parte inferior de una berenjena en descomposición. Ella estaba tomando un curso de la Universidad de KwaZulu-Natal sobre virus que atacan a las bacterias, y una verdura putrefacta le parecía un buen lugar para encontrarlos y cumplir con su tarea. A nivel microscópico, la estudiante descubrió exactamente lo que buscaba: un virus de bacterias (bacteriófago) nunca antes descrito y que mata a ciertas micobacterias. A este “fago” lo llamó Muddy (lodoso en inglés) y siguió con su vida. Muddy, mientras tanto, fue guardado en un tubo entre miles en un congelador de un laboratorio de la Universidad de Pittsburgh, Pensilvania, a cargo de la Dra. Helen Spencer.
La investigación acerca de los fagos no es algo nuevo, incluso en el contexto de tratamiento de enfermedades. En las primeras décadas del siglo XX, ya se usaban en el tratamiento de enfermedades, al menos en algunos lugares de Europa del Este y Rusia. Sin embargo, en la ciencia occidental, el descubrimiento de los antibióticos desplazó el interés hacia los fagos y sus potenciales usos. En comparación con la novedad y versatilidad de los antibióticos, los fagos solo pueden matar a ciertas bacterias de manera muy específica. En ese entonces, esto no sonaba como algo muy atractivo ni prometedor como para continuar la investigación en fagos y sus posibles usos terapéuticos.
¿Cómo funciona la terapia de fagos?
De manera resumida, el mecanismo de los fagos implica “aterrizar” sobre una bacteria e inyectar su ADN dentro de ella (Figura 3), para así poder reproducirse aprovechando la maquinaria celular de la bacteria. Por lo tanto, las bacterias mueren liberando miles de nuevos fagos que pueden continuar infectando a otras bacterias. Cabe mencionar que esta infección es muy específica, por lo que es posible tener fagos que infectan a cierta cepa de cierta especie de bacteria. Por lo tanto, en el caso de tener una bacteria patógena y resistente a los antibióticos, es posible realizar tratamientos contra estas sin afectar a otras bacterias que pueden ser benéficas o parte de nuestro microbioma. Sin embargo, lo difícil es poder encontrar a estos pequeños virus con la especificidad necesaria, a diferencia de los antibióticos que pueden ser sintetizados en el laboratorio.
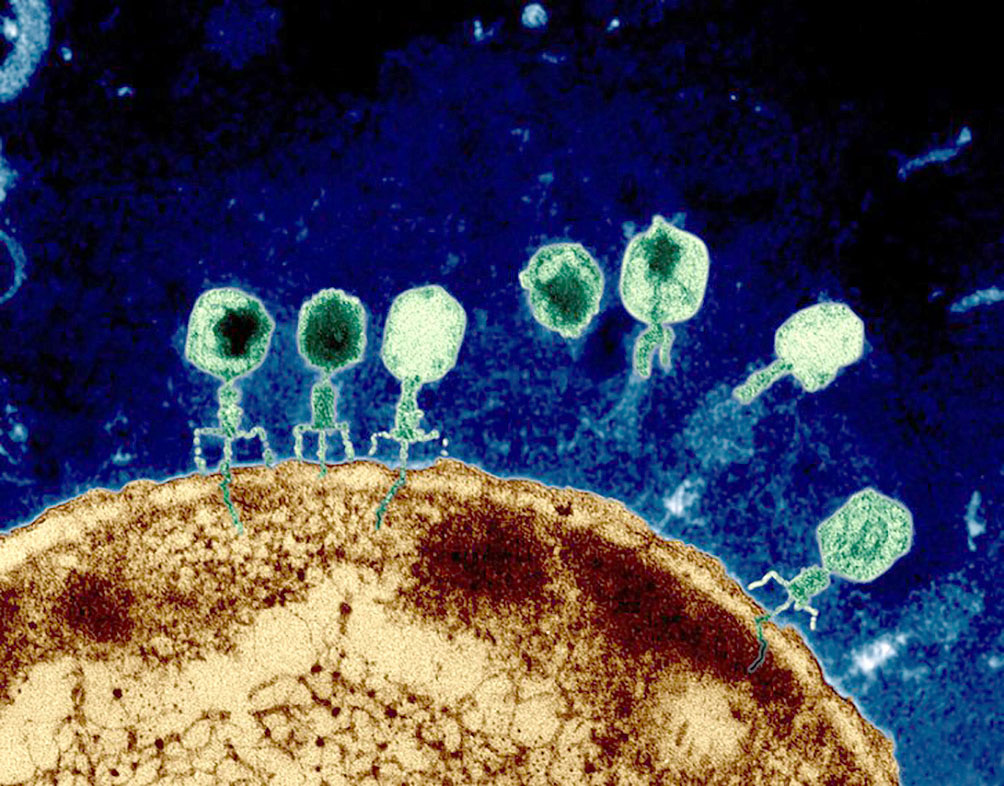
Figura 3. Bacteriófagos infectando una bacteria. Tomada de https://www.newyorker.com/tech/annals-of-technology/phage-killer-viral-dark-matter
Como ya se mencionó, la terapia de fagos sigue siendo un tratamiento aun en fase experimental y no es aceptado aun en muchos países. Sin embargo, muchos pueden opinar que, para situaciones extremas se requieren soluciones extremas. Tal fue el caso de Isabelle Holdaway, una joven de 15 años en Londres, Inglaterra, con fibrosis quística y una infección diseminada de Mycobacterium abscessus. A pesar de los tratamientos con antibióticos por más de seis meses, no se lograba su recuperación. Entonces, los médicos decidieron optar por la “terapia de fagos” y que no había sido probada anteriormente en este tipo de casos. Este seria el primer caso donde un paciente es tratado con fagos genéticamente modificados.
Muddy y otros fagos al rescate
No fue sino hasta casi nueve años después, que un tubo entre miles en un congelador, encerraría la cura y ultima esperanza de una joven de 15 años. Aquel fago aislado de una berenjena podrida era el candidato ideal para eliminar la cepa especifica de bacteria que la infectaba. Sin embargo, los investigadores sabían de la probabilidad de que la bacteria también generara un mecanismo en el cual se hiciera resistente al ataque del fago, por lo que debían encontrar otros fagos que pudieran ayudar. Tenían otros dos fagos (llamados ZoeJ y BPs) que eran tan específicos como Muddy pero no tan buenos eliminando a la bacteria. No obstante, los tomaron como un punto de partida para crear variantes con mucho mayor efectividad, por medio de ingeniería genética. Eliminando y modificando algunos genes en dichos fagos, crearon junto con Muddy, un coctel el cual fue enviado a Londres y utilizado en las lesiones externas y posteriormente, en el torrente sanguíneo de la joven. Lentamente, las heridas comenzaron a cerrarse y la infección a ceder. Después de casi un año de tratamiento, aun hay algunos rastros de la bacteria en su sistema, pero nada que le impida llevar una vida casi normal.
La terapia de fagos puede ser una opción prometedora pero que requiere de mas investigación. Su uso no se limita al tratamiento de enfermedades humanas, sino también podría emplearse en animales de producción donde existe un uso irracional de antibióticos. Posiblemente existan otras aplicaciones biotecnológicas y otras que aun no alcanzamos a vislumbrar, pero de nuevo, nadie pensaría en la pregunta: “¿Cuál es la aplicación biotecnología de estudiar una berenjena podrida?”. Al cabo de 10 años, el proyecto de ciencias de una estudiante de Sudáfrica, le ha salvado la vida a Isabelle Holdaway.
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos. Desde la Academia de Ciencias de Morelos externamos nuestra preocupación por el vacío que genera la extinción de la Secretaría de Innovación, Ciencia y Tecnología dentro del ecosistema de innovación estatal que se debilita sin la participación del Gobierno del Estado.
Referencias
https://es.wikipedia.org/wiki/El_huevo_o_la_gallina
https://es.wikipedia.org/wiki/Lisozima
https://es.wikipedia.org/wiki/Penicilina
https://www.who.int/es/news-room/detail/27-02-2017-who-publishes-list-of-bacteria-for-which-new-antibiotics-are-urgently-needed
Lecturas recomendadas
https://es.wikipedia.org/wiki/Alexander_Fleming
https://www.biografiasyvidas.com/biografia/f/florey.htm
https://www.biografiasyvidas.com/biografia/c/chain.htm
https://en.wikipedia.org/wiki/Norman_Heatley
https://okdiario.com/curiosidades/como-descubrio-penicilina-511063
https://www.biografiasyvidas.com/monografia/fleming/penicilina.htm
https://www.statnews.com/2019/05/08/phage-therapy-how-genetically-engineered-viruses-may-have-prolonged-teens-life/
https://www.vox.com/future-perfect/2019/5/14/18618618/phage-therapy-antibiotic-resistance
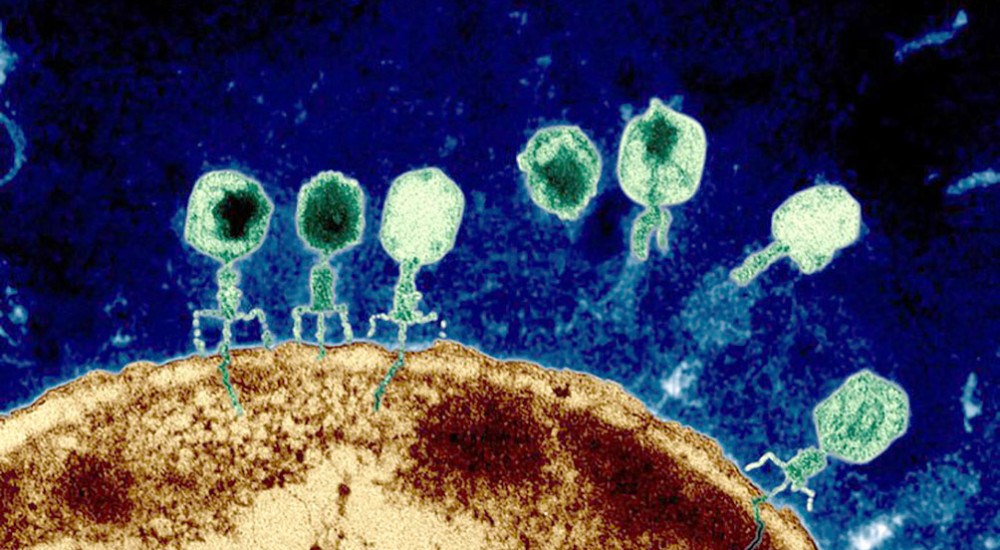






 Figura 1. Estructura de la penicilina. Tomada de
Figura 1. Estructura de la penicilina. Tomada de 

 Desarrollado por Linabat
Desarrollado por Linabat