Premio Nobel de Medicina 2019
Georgina Hernández Montes
RAI-UNAM
La Dra. Georgina Hernández Montes es Química Farmacobióloga egresada de la Facultad de Química de la UNAM. Actualmente es parte de la Red de Apoyo a la Investigación (RAI) de la UNAM y se ha especializado en el área de bioinformática. Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
Como se ha mencionado en las dos columnas previas, en la primera semana de octubre se dan a conocer las aportaciones más valiosas en diferentes campos de la ciencia. En esta entrega se aborda el Premio Nobel de Fisiología y Medicina (Figura 1) que este año fue compartido entre el profesor de Medicina William G. Kaelin, Jr., el médico británico Sir Peter J. Ratcliffe y el médico y profesor Gregg L. Semenza, gracias a sus descubrimientos de cómo las células perciben y se adaptan a la disponibilidad de oxígeno. Antes de revisar la importancia de sus trabajos es necesario mencionar el papel del oxígeno en el origen y evolución de la vida.


Figura 1. Galardonados con el premio Nobel de Fisiología y Medicina 2019. Figura tomada de https://www.ngenespanol.com/ciencia/investigacion-celulas-se-adaptan-al-oxigeno-gana-nobel-de-medicina-2019/
El oxígeno en el origen de la vida
El oxígeno es el tercer elemento más abundante en el universo, pero es esencialmente irrespirable ya que es tan activo que se une al polvo estelar antes que a sí mismo. En la Tierra la historia ha sido muy diferente, ya aquí lo podemos encontrar en su forma diatómica (O2) debido a su producción por la actividad fotosintética de diferentes organismos. Sin embargo, esto no siempre fue así, el planeta se formó hace aproximadamente 4,500 millones de años junto con el resto del Sistema Solar, pero debido a sus condiciones particulares hace aproximadamente 3,500 millones de años se formaron los primeros organismos. Es necesario mencionar que aun en aquella época, la cantidad de oxígeno disponible era extremadamente baja. De acuerdo con los expertos se calcula que estaba presente en un 0.001%, es decir, que la vida se originó en condiciones anaerobias. Según los registros geológicos, aproximadamente hace 2,000 millones de años ocurrió lo que se conoce como el gran evento de oxidación. Se propone que las bacterias desarrollaron la capacidad de disociar el agua, utilizando la energía obtenida del sol (fotosíntesis oxigénica) a través de pigmentos conocidos como clorofila, y empezaron a producir oxígeno como un desecho. A partir de entonces otros organismos también empezaron a desarrollar estrategias para utilizar y protegerse de este nuevo elemento ya que es altamente oxidante. La hipótesis de la relación entre este evento de oxidación y el origen de las células modernas fue propuesta por la destacada bióloga Lynn Margulis, quien propone que las mitocondrias (los organelos que gestionan el oxígeno dentro de nuestras células) proceden de bacterias antiguas de vida libre.
El oxígeno y los seres vivos en la actualidad
Los seres vivos pueden clasificarse en dos grandes grupos, los eucariontes y los procariontes. Dentro de los procariontes se encuentran las bacterias cuya característica principal es que son unicelulares, tienen amplias capacidades metabólicas que van desde crecer en ambientes extremos como altas temperaturas, altas concentraciones de azufre o sal, e incluso en ambientes con radioactividad. Otra característica es que los componentes dentro de la célula procarionte se encuentran distribuidos en el citoplasma. Mientras que los organismos eucariontes en su gran mayoría son multicelulares, sus capacidades metabólicas son mucho más limitadas, tienen la característica que el interior de la célula está compartamentalizada y con diferentes organelos que cumplen funciones específicas (Figura 2).

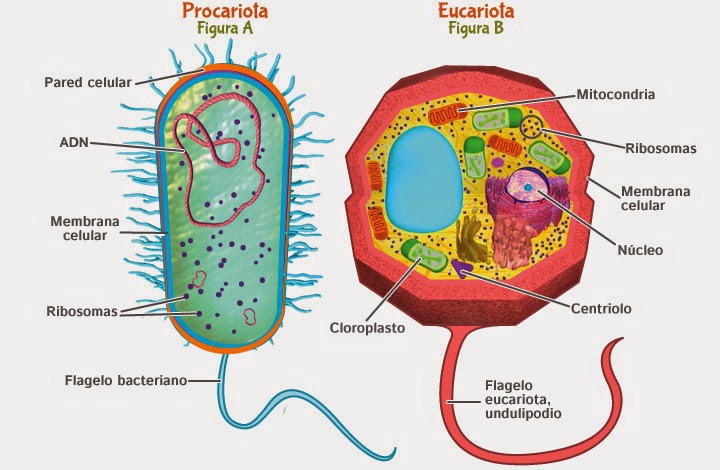
Figura 2. Tipos celulares. En esta imagen se pueden observar las diferencias estructurales entre los dos tipos de células eucariontes y procariontes. Figura tomada de https://medium.com/@adrian1mederos/qu%C3%A9-son-las-c%C3%A9lulas-eucariotas-y-que-son-las-c%C3%A9lulas-procariotas-aea423b1821a
El organelo que más nos interesa para el presente tema es la mitocondria (Figura 3). Aunque su descubrimiento es un hecho colectivo como muchos otros en la ciencia, este organelo fue nombrado en 1889 por el microbiólogo alemán Carl Benda. Son estructuras con forma de bastón que tienen dos membranas, una interna y otra externa donde se están embebidos diferentes complejos proteicos que realizan la oxidación de muchos metabolitos y producen energía. Este es un proceso fundamental para la vida de cualquier organismo eucarionte.

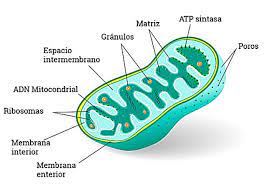
Figura 3. Mitocondria. La mitocondria es un organelo que consta de dos membranas, ADN mitocondrial y complejos enzimáticos que llevan a cabo funciones metabólicas fundamentales. Tomada de https://www.celulaanimal.info/partes/mitocondria/
De células a organismos
Si bien a nivel celular se desarrollaron estrategias para utilizar el oxígeno, a través de la evolución los humanos desarrollaron diferentes mecanismos para garantizar un suministro suficiente de oxígeno a las células y los tejidos. El principal mecanismo en los humanos es el cuerpo carotídeo, que es un conjunto de células que están situadas en el cuello, en la bifurcación de la arteria carótida, donde esta arteria se divide en carótida interna y carótida externa. El cuerpo carotídeo tiene la función de detector del nivel de oxígeno y participa en la regulación de la respiración. Este descubrimiento le mereció el Premio Nobel de Fisiología y Medicina de 1938 a Corneille Heymans cuyos estudios mostraron cómo la detección de oxígeno en la sangre a través del cuerpo carotídeo controla nuestra frecuencia respiratoria al comunicarse directamente con el cerebro.
La eritropoyetina y el camino al Nobel
Cuando el cuerpo se encuentra en condiciones donde hay bajos niveles de oxígeno (hipoxia) se producen algunas adaptaciones fisiológicas, una de ellas es el aumento en el tamaño del cuerpo carotídeo Sin embargo, no es la única adaptación ya que otra respuesta fisiológica clave a la hipoxia es el aumento de los niveles de la hormona eritropoyetina (EPO), que conduce a una mayor producción de glóbulos rojos (eritropoyesis). Aunque la importancia de este mecanismo ya se conocía a principios del siglo XX, la forma en que este proceso fue controlado por el O2 seguía siendo un misterio.
Gregg Semenza nació en 1956 en Nueva York y actualmente se desempeña en la Facultad de Medicina de la Universidad Johns Hopkins. Mientras realizaba su posdoctorado en la misma universidad, se interesó por el gen EPO y su regulación en respuesta a niveles variables de oxígeno. Decidió utilizar ratones modificados genéticamente para determinar cómo se afectaba la producción de EPO. Unos de sus resultados demostraron que segmentos específicos de ADN ubicados al lado del gen EPO mediaban la respuesta a la hipoxia. Así mismo descubrió un complejo proteico que se une al segmento de ADN identificado de una manera dependiente del oxígeno. Llamó a este complejo el factor inducible por hipoxia (HIF). Se iniciaron grandes esfuerzos para purificar el complejo HIF, y en 1995 Semenza pudo publicar algunos de sus hallazgos clave, incluida la identificación de los genes que codifican HIF. Se descubrió que HIF consistía en dos proteínas de unión a ADN diferentes, llamadas factores de transcripción, ahora llamados HIF-1α y ARNT. Ahora los investigadores podrían comenzar a resolver el rompecabezas, permitiéndoles comprender qué componentes adicionales estaban involucrados y cómo funciona la maquinaria.
La regulación de la eritropoyetina en otros órganos
De manera paralela Sir Peter Ratcliffe, quien actualmente trabaja en la Universidad de Oxford, también se encontraba estudiando la regulación del gene EPO y también encontró que el ARN mensajero (ARNm) producido en las células de los riñones, forma parte de la vía de producción de EPO. Este mecanismo para detectar la hipoxia, también se está presente en varios otros órganos, tanto humanos como animales, incluidos el bazo, el cerebro y los testículos. Su grupo descubrió también que las células de estos órganos podrían activar la producción de EPO cuando se les priva de oxígeno. Posteriormente, Ratcliffe pudo modificar otras células para dar a estas células capacidades de detección de oxígeno utilizando el ARNm identificado.
Actualmente se sabe que cuando los niveles de oxígeno son altos, las células contienen muy poco HIF-1α. De manera inversa, cuando los niveles de oxígeno son bajos, la cantidad de HIF-1α aumenta para que pueda unirse y así regular la expresión del gen EPO y otros genes también tienen segmentos de ADN que se unen a HIF. Otros estudios mostraron que HIF-1α se degrada rápidamente. Sin embargo, en condiciones de hipoxia esta proteína está protegido de la degradación. El mecanismo de degradación de HIF-1α se lleva a cabo por una máquina celular llamada proteasoma y cuya identificación le mereció el premio Nobel de Fisiología y Medicina de 2004 a Aaron Ciechanover, Avram Hershko e Irwin Rose. El mecanismo consiste en pegar un péptido pequeño, ubiquitina, a la proteína HIF-1α. La ubiquitina funciona como una etiqueta para proteínas destinadas a la degradación en el proteasoma. Si bien el mecanismo había sido descrito, la forma en que la ubiquitina se une a HIF-1α de manera dependiente del oxígeno estaba por descubrirse.
La disponibilidad de oxígeno y el cáncer
William Kaelin, Jr nacó en 1957 en Nueva York y actualmente es miembro de la Universidad de Harvard y del Dana-Farber Cancer Institute. Su trabajo fue fundamental para poder concretar la investigación que ahora explica los mecanismos de cómo las células perciben y se adaptan a la disponibilidad de oxígeno. Klein estaba investigando, la enfermedad de von Hippel-Lindau (enfermedad de VHL) un síndrome hereditario. Esta enfermedad genera una mayor predisposición a desarrollar ciertos tipos de cáncer, a los individuos con mutaciones heredadas de VHL. Kaelin demostró que el gen VHL codifica una proteína que previene la aparición de cáncer. Así mismo demostró que las células cancerosas que carecen de un gen VHL funcional expresan niveles anormalmente altos de genes regulados por hipoxia; cuando se restablece la presencia del gen VHL en estas células, los genes regulados por hipoxia se restablecen a niveles normales. Posteriormente otros grupos de investigación que demostraron que VHL es parte de un complejo que etiqueta las proteínas con ubiquitina, marcándose para la degradación en el proteasoma. Con estos antecedentes Ratcliffe y su grupo de investigación hicieron un descubrimiento clave: demostraron que VHL puede interactuar físicamente con HIF-1α y es necesario para su degradación a niveles normales de oxígeno.
Aunque ya se tenía una descripción muy clara de este mecanismo, no se comprendía cómo los niveles de O2 regulan la interacción entre VHL y HIF-1α. En 2001 se demostró que, bajo niveles normales de oxígeno, se agregan grupos hidroxilo en dos posiciones específicas en HIF-1α. Esta modificación llamada prolil hidroxilación, permite que VHL reconozca y se una a HIF-1α y, por lo tanto, explica cómo los niveles normales de oxígeno controlan la degradación rápida de HIF-1α con la ayuda de enzimas sensibles al oxígeno. Investigaciones posteriores de Ratcliffe y otros, identificaron las prolil hidroxilasas responsables del mecanismo y se demostró que la función de activación de genes de HIF-1α estaba regulada por hidroxilación dependiente de oxígeno.
La regulación del oxígeno y su aplicación en la medicina
Es así como gracias al trabajo de estos premios Nobel, sabemos cómo los diferentes niveles de oxígeno regulan los procesos fisiológicos fundamentales. Actualmente entendemos a detalle cómo las células pueden adaptar su metabolismo a niveles bajos de oxígeno para sobrevivir, ya sea generando nuevos vasos sanguíneos y produciendo más glóbulos rojos. Nuestro sistema inmunológico y muchas otras funciones fisiológicas también están afinadas por la maquinaria de detección de O2. Incluso se ha demostrado que la detección de oxígeno es fundamental durante el desarrollo fetal para controlar la formación normal de vasos sanguíneos y el desarrollo de placenta.
Estos estudios también nos han permitido entender el papel de la detección de oxígeno en las enfermedades. Por ejemplo, los pacientes con insuficiencia renal crónica a menudo sufren de anemia severa debido a la disminución de la expresión de EPO. También se ha observado un papel relevante en la formación de tumores, y que este mecanismo estimula la formación de vasos sanguíneos y remodelar el metabolismo para permitir la proliferación efectiva de células cancerosas. Es por esto por lo que muchos de los esfuerzos para combatir el cáncer se enfocan en el desarrollo de medicamentos que pueden activar o bloquear la maquinaria de detección de oxígeno.
Al igual que los premios anteriores, este es un premio colectivo que nos muestra por qué los grandes descubrimientos no son productos del trabajo de una sola persona ni de un periodo de tiempo corto. Son trabajos que han requerido de más de una década de trabajo, por ello quiero reiterar la importancia de seguir apoyando la ciencia y la tecnología, teniendo en cuenta en que los resultados inmediatos, pero la ganancia a largo plazo puede llegar a beneficiar a toda la humanidad.
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos. Desde la Academia de Ciencias de Morelos externamos nuestra preocupación por el vacío que genera la extinción de la Secretaría de Innovación, Ciencia y Tecnología dentro del ecosistema de innovación estatal que se debilita sin la participación del Gobierno del Estado.
Ligas de interés
https://www.nobelprize.org/
http://web.ecologia.unam.mx/oikos3.0/index.php/todos-los-numeros/articulos-anteriores/184-oxigeno-y-la-vida
https://www.nature.com/articles/d41586-019-02963-0













 Desarrollado por Linabat
Desarrollado por Linabat