Las vacunas contra COVID-19: Un resumen de su desarrollo y avances
Nicté Luna
Nicté Luna es Mtra. en Filosofía de la Ciencia en el área de Comunicación de la Ciencia. Actualmente es académica del IER-UNAM.
Hay varios memes que han circulado en las últimas semanas en redes sociales sobre las vacunas contra la COVID-19 que aluden a la desconfianza de aplicarla, en parte por la rapidez con la que fue desarrollada. Al inicio de la pandemia se decía que la vacuna estaría lista en este 2021, pero para bien de todas las personas, diferentes grupos de investigación lograron tener lista su respectiva vacuna en menos tiempo. En esta columna, se ha seguido a detalle los resultados para varias de estas vacunas (http://www.acmor.org/articulo/la-carrera-hacia-la-vacuna-contra-covid-19-primera-parte; http://www.acmor.org/articulo/la-carrera-hacia-la-vacuna-contra-covid-19-segunda-parte; http://www.acmor.org/articulo/covid19-casi-un-ano-del-inicio-de-la-pandemia-segunda-parte; http://www.acmor.org/articulo/covid-19-lo-que-debemos-saber-de-las-variantes-y-vacunas-en-mexico), pero aquí hacemos un repaso de los puntos mas relevantes que uno debe recordar, referente al desarrollo de una vacuna y como el proceso nos garantiza su seguridad y eficacia. Las vacunas no se desarrollan de la noche a la mañana; todas pasan por un proceso de investigación riguroso que va desde el estudio a nivel laboratorio con animales, seguido por los estudios clínicos en personas hasta llegar a la aprobación de la vacuna por parte de las instituciones competentes de cada país.
Primeros pasos: estudios de laboratorio y de animales
Etapa exploratoria. Para iniciar el desarrollo de una vacuna es necesario hacer una investigación básica de laboratorio para identificar los antígenos naturales o sintéticos que podrían ayudar a prevenir o tratar la enfermedad de interés. Esta investigación requiere de un conocimiento muy profundo del agente patógeno y de la enfermedad que ocasiona. En el caso del SARS-CoV-2 y la COVID-19, hay que recordar que es muy poco tiempo el que se tiene de estudios, pero es importante considerar los avances gigantescos logrados en este tiempo. Con estos conocimientos, es en esta etapa en donde los grupos de investigación deciden qué tecnología utilizarán para desarrollar su vacuna. Por ejemplo, pueden emplear antígenos que incluyan partículas similares a virus o bacterias, virus debilitados u otras sustancias derivadas de patógenos. Para COVID-19 existen varios desarrollos que van desde utilizar vacunas de ARNm (como la de Pfizer y Moderna) hasta virus atenuados o inactivados (como la de Sinovac o Sinopharm).
Preclínica. Una vez que tienen la fórmula de su vacuna, a la que llamaremos vacuna candidata, inician los estudio preclínicos para evaluar la seguridad de ésta y su capacidad de provocar una respuesta inmunitaria. La vacuna candidata se aplica en ratones o monos para tener una idea de la respuesta celular que se podría esperar en los seres humanos. También se analiza la cantidad de dosis que es segura para poder pasar a la siguiente fase de investigación: la aplicación en humanos. Asimismo, se analiza el método seguro para administrar la vacuna, este puede ser en gotas o inyectable. Por ejemplo, la farmacéutica francesa SANOFI en conjunto con la empresa Translate Bio, tienen en esta fase un candidato a vacuna que genera una fuerte respuesta de anticuerpos en ratones y monos y se planea continuar a la fase 1 para el primer cuarto del 2021. Otro ejemplo interesante de candidato a vacuna que está en la fase preclínica, es la de la Universidad de Pittsburgh. El desarrollo llamado PittCoVacc es un parche cutáneo con 400 agujitas hechas con un tipo de azúcar que se disuelve en la piel, liberando proteínas del virus para que se genere una respuesta inmune. Aun se encuentran en los permisos para la siguiente fase.
Segundo paso: Estudios clínicos con personas
Fase 1. Una vez que se prueba la seguridad de la vacuna en animales, es decir, que no causa efectos secundarios graves o letales en ellos, se pasa a los estudios clínicos con personas. En este primer ensayo se aplica la vacuna candidata a un grupo pequeño de adultos, entre 20 y 80 sujetos con la finalidad de evaluar su seguridad en las personas. En esta fase, los ensayos pueden no ser ciegos, es decir, quienes participan del estudio saben si se les aplica una vacuna o un placebo. Además, en esta fase se estudia el alcance de la respuesta inmune que provoca la vacuna. Si se obtienen resultados prometedores en esta etapa, se pasa a la siguiente.
Fase 2. En las pruebas de esta fase participa un grupo más grande de personas, hablamos de cientos de ellas. Estos ensayos clínicos son aleatorios y están bien controlados, a algunos sujetos se les aplica un placebo y a otros la vacuna candidata. En esta fase se estudia la seguridad, la respuesta inmune, la dosis, la duración de la inmunidad y el método de administración de la vacuna candidata. Algo importante de mencionar es que, para las vacunas contra SARS-CoV-2, se autorizó fusionar la fase 1 y la fase 2, para poder acelerar el proceso y obtención de resultados. Esto no ha sido un atajo donde se hayan omitido pasos, sino un gran esfuerzo de inversión y coordinación para poder reunir a los voluntarios y realizarles todas las pruebas antes y después de la vacuna.
Fase 3. Aquellas vacunas candidatas que son exitosas en la fase 2 pasan a los ensayos de la fase 3: su aplicación en decenas de miles de personas. Estas pruebas son aleatorias y de doble ciego, es decir, quienes participan en el estudio no saben si se les aplicó la vacuna candidata o un placebo. En esta fase se sigue evaluando la seguridad pues es posible que algunos efectos secundarios raros aparecen, ya que muchas veces no se logran observar en grupos más pequeños, evaluados en las fases anteriores. Además, en esta etapa se sigue estudiando la respuesta inmune y es donde se prueba la eficacia de la vacuna, es decir, si la vacuna candidata previene la enfermedad para la que fue creada. Dependiendo del protocolo que se registre para esta fase, es posible liberar resultados preliminares con la finalidad de tomar decisiones como una aprobación para uso de emergencia.
Tercer paso: Aprobación
Después de un ensayo exitoso en la fase 3, el desarrollador de la vacuna solicita su licencia sanitaria a la institución competente, en el caso de México es la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS), mientras que en Estados Unidos es la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés). Con la aprobación de esta instituciones es posible la aplicación de la vacuna en el país correspondiente. Como se mencionó anteriormente, se puede aprobar una vacuna aun sin haber terminado por completo la fase 3, pero esto es en casos de emergencia sanitaria extrema, como la que estamos viviendo.

Figura 1: Pasos para desarrollar una vacuna. Una adaptación de David M. Knipe, Et. al (11 Dec 2020:). Ensuring vaccine safety, Science. Disponible en: https://science.sciencemag.org/content/370/6522/1274
Proceso para el desarrollo de vacunas en tiempos de pandemia
Con este esquema lineal, el desarrollo de una vacuna puede llevar hasta 15 años de investigación para llegar a la aprobación y poderse aplicar a la población. Sin embargo, la emergencia sanitaria que vivimos desde el 2020 puso a trabajar arduamente a diversos grupos de investigación de todo el mundo para obtener en poco tiempo varias vacunas candidatas contra el virus SARS-CoV-2 que provoca la enfermedad COVID-19. Esta urgencia llevó a practicar un nuevo paradigma pandémico para desarrollar vacunas entre 10 meses y 1.5 años, con un inicio rápido y muchos pasos ejecutados de forma paralela incluso antes de confirmar los resultados exitosos de otro paso. Por ejemplo, los ensayos clínicos de fase 1 continuaban paralelamente con las pruebas en animales. También se tuvo que identificar las instalaciones capaces de producir grandes cantidades de vacunas y adaptar el proceso de fabricación a la par de las pruebas clínicas, incluso antes de pasar las tres fases. Posiblemente, tanto la producción como la logística de distribución de las vacunas serán los mayores retos que se tienen para el caso de COVID-19, por lo que aunque la parte científica está hecha, aun existen otros cuellos de botella que hay que sortear.

Figura 2. Nuevo paradigma pandémico Fuente: Nicole Lurie, Et.al. (Marzo, 30 2020) Developing Covid-19 Vaccines at Pandemic Speed. The New England Journal of Medicine. Disponible en https://www.nejm.org/doi/full/10.1056/NEJMp2005630
Las vacunas contra COVID-19
Como ya se ha explicado en otras entregas, los desarrolladores de la vacuna contra COVID-19 han utilizado diferentes tecnologías, pero aquí repasaré dos de ellas: las que usaron virus vectores y las que utilizaron ARN mensajero.
Vacunas de ARN mensajeros. Esta es una tecnología reciente y consiste en introducir en nuestro organismo el ARN mensajero (ARNm) que es el encargado de dar las instrucciones para que nuestras células produzcan el antígeno y así desencadenar la reacción de nuestro sistema inmune. Las vacunas BNT162b2 (conocida en México como vacuna Pfizer) que desarrollaron los laboratorios Pfizer y BioNtech y la vacuna de Moderna desarrollada en Estados Unidos utilizan una secuencia de ARNm que codifica la proteína conocida como pico o spike -recordemos que el virus SARS-CoV-2 utiliza esta proteína para penetrar las células del organismo-, este ARNm está envuelto en una capa de lípidos. Una vez que se aplica esta vacuna, las células leen la información del ARN mensajero para producir la proteína pico con la finalidad de estimular al sistema inmunológico a producir anticuerpos que protegen al organismo cuando el SARS-CoV-2 ingrese al cuerpo. La vacuna Pfizer ha sido la primera en aplicarse en México. Tiene 95% de eficacia, requiere dos inyecciones con 21 días de diferencia y su almacenamiento debe mantenerse a temperaturas muy bajas de -70 °C. La vacuna Moderna tiene una eficacia de 94.5%, requiere de dos dosis y puede mantenerse almacenada a una temperatura de entre los 2 y 8°C durante 30 días. Si se conserva a -20°C puede ser estable hasta por 6 meses.
Vacunas de virus vectores. Este tipo de tecnología consiste en utilizar virus inofensivos para el organismo de las personas, por ejemplo, el virus del resfriado que afecta a los chimpancés, como transportadores para introducir la proteína, en este caso la pico, y así provocar la respuesta inmunitaria de nuestro cuerpo. Las vacunas AZD1222 de la Universidad de Oxford y AstraZeneca -conocida en México como vacuna AstraZeneca-, la Ad5-nCoV de CanSino Biologics y la Sputnik V desarrollada por Rusia utilizan esta tecnología. La vacuna AstraZenenaca tiene una eficacia del 70,4% y requiere mantenerse almacenada a una temperatura de entre 2 y 8°C. La vacuna Ad5-nCoV tiene una eficacia de 97% y su almacenamiento es a temperatura ambiente. La Sputnik V tiene una eficacia del 92% y debe almacenarse a -20°C si está líquida y puede estar entre 2 a 8°C si está liofilizada. De estas vacunas sólo la de CanSino Biologics requiere una dosis, las demás se aplican en dos dosis.

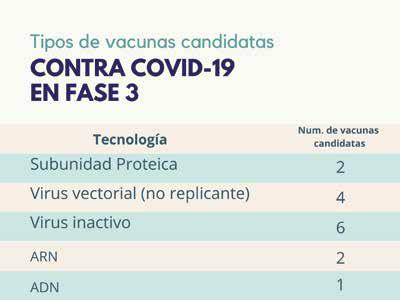
Figura 3. Tipos de vacunas candidatas contra la COVID 19 en fase 3. Fuente: https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines
Efectos secundarios de las vacunas
La rapidez con que se desarrollaron las vacunas contra COVID-19 han generado dudas entre las personas, pues se teme por los posibles efectos secundarios de la vacunación. Sin embargo, ante la aplicación de cualquier vacuna es normal tener ciertas reacciones como enrojecimiento, hinchazón o dolor alrededor de la zona de la inyección. También se puede sufrir fiebre, dolor de cabeza o de las extremidades. Estas reacciones suelen ser leves y desaparecen después de pocos días, son señales de que la vacuna está funcionando ya que estimulan el sistema inmunológico y el cuerpo forma anticuerpos contra lo que interpreta es una infección producida por la vacunación. De acuerdo a los desarrolladores de las vacunas Pfizer, Moderna, AstraZeneca y Sputnik V estas producen estos efectos secundarios habituales. En el caso de la Pfizer, también se ha reportado que algunos pacientes presentaron una reacción alérgica grave inmediatamente después de la inyección, de ahí que se recomiende que las personas que son alérgicas a ciertos compuestos de la vacuna o que hayan sufrido algún choque anafiláctico, no se la apliquen.

Figura 4. Síntomas habituales de las vacunas, estos suelen ser leves y desaparecen después de pocos días de la aplicación.
En resumen, la pandemia de la COVID 19 nos llevó a desarrollar una diversidad de vacunas en un tiempo sin precedentes, pero bajo los estándares que garantizan la seguridad para las personas. Por lo tanto, es seguro aplicárselas y no debe temerse, ya que actualmente, los riesgos que uno puede correr al aplicarse la vacuna son mucho menores que los que tenemos al infectarnos.
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos. Desde la Academia de Ciencias de Morelos externamos nuestra preocupación por el vacío que genera la extinción de la Secretaría de Innovación, Ciencia y Tecnología dentro del ecosistema de innovación estatal que se debilita sin la participación del Gobierno del Estado.
Referencias:
- DAVID M. KNIPE, OFER LEVY, KATHERINE A. FITZGERALD, ELKE MÜHLBERGER. Ensuring vaccine safety. SCIENCE. 11 de Diciembre 2020: 1274-1275
- DW news. COVID-19: Risks and side effects of vaccination. Disponible en https://bit.ly/3989wuo
- James Paton. (Noviembre 17, 2020) The Two Vaccines Have Much in Common. Bloomberg
- Julie. Top 3 COVID-19 vaccine candidates and how they work. Disponible en: https://bit.ly/3bosrEi
- Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3
- The Historia of Vaccines. Vaccine Development, Testing, and Regulation. Disponible en: https://bit.ly/35opAr0
Ligas de interés:












 Desarrollado por Linabat
Desarrollado por Linabat