Desapareciendo cristales (Segunda Parte)
José Manuel Cruz y Thomas Buhse
El Dr. José Manuel Cruz Martínez obtuvo su Doctorado en Ciencias en la Universidad Autónoma del Estado de Morelos; actualmente es académico en la Facultad de Ciencias en Física y Matemáticas de la Universidad Autónoma de Chiapas. El Dr. Thomas Buhse obtuvo su Doctorado en Química en la Universität Bremen de Alemania y actualmente es miembro del Centro de Investigaciones Químicas – IICBA de la Universidad Autónoma del Estado de Morelos.
En la primera parte de nuestra contribución (La Unión de Morelos, 28/09/2020 http://www.acmor.org/articulo/desapareciendo-cristales-primera-parte), presentamos el extraño caso de los cristales que desaparecen repentinamente, es decir, formas cristalinas polimórficas que dejan de estar disponibles para su síntesis debido al efecto de la siembra no intencional de una forma polimórfica diferente, que puede "infectar" todo el laboratorio o fábrica, incluso de empresas farmacéuticas internacionales con plantas en todo el mundo. También en la primera parte mostramos que este efecto puede tener consecuencias dramáticas, tanto para los pacientes como para la economía de las empresas involucradas. Relatamos el caso quizás más notorio, el del Ritonavir o Norvid®, un fármaco antiviral, que de repente ya no se pudo producir en los laboratorios a pesar de seguir, cuidadosamente, el procedimiento ya establecido. Este paro en la producción dejó a los pacientes con VIH sin el medicamento durante un tiempo considerable. Sin embargo, el caso del Ritonavir no fue un evento aislado.
El caso de la Ranitidina
Otro ejemplo de la desaparición de cristales tiene que ver con el conocido medicamento Ranitidina, comercializado como Zantac®, un fármaco utilizado para reducir la producción de ácido estomacal. Recientemente Zantac® fue retirado del mercado, después de una advertencia de la Administración de Alimentos y Medicamentos (FDA) de EE.UU., debido a que este medicamento contiene una impureza (N-nitrosodimetilamina) que puede aumentar considerablemente el riesgo de desarrollar cáncer.

Figura 1. Zantac® fue un medicamento distribuido en todo el mundo que contiene Ranitidina, un compuesto químico que muestra polimorfismo.
La Ranitidina tiene una historia muy interesante relacionada con polimorfismo. Siguiendo un procedimiento descrito en una patente estadounidense de 1978, Allen & Hanbury (ahora Glaxo Smith Kline) desarrolló la producción de ranitidina hasta la escala de planta piloto. Sin embargo, de repente, en 1980 el producto químico no pasó las pruebas de calidad de rutina, igual a como ocurrió con el Ritonavir, sugiriendo la aparición de una nueva forma cristalina y la desaparición de la primera forma cristalina (polimorfo 1), por lo que ya no fue posible seguir produciendo el polimorfo 1 mediante el procedimiento patentado. En 1984, con la nueva forma polimórfica (polimorfo 2) y con una nueva patente, Glaxo comenzó la venta mundial de Zantac®. La patente original del polimorfo 1 expiró en 1995, lo que llevó a otras compañías farmacéuticas a intentar producir Ranitidina en la forma polimórfica 1, sin necesidad de usar la patente del polimorfo 2, en poder de Glaxo. Se realizaron numerosos intentos usando la patente original y todos fracasaron, en las cristalizaciones siempre se obtuvo el polimorfo 2. Incluso, una empresa (Novopharm) alegó que Glaxo nunca había obtenido al polimorfo 1 como producto de reacción, lo que generó una batalla legal sobre la nueva patente, ya que se basaba en la patente original que, sin embargo, también daba como resultado la cristalización del polimorfo 2.
Durante la batalla legal, el abogado de Novopharm argumentó (reproducido de DK Bučar et al., Disappearing Polymorphs Revisited. Angew. Chem. Int. Ed. 2015, 54, 6972-6993): “Ellos (Glaxo) reprodujeron el “ejemplo 32” (la patente para el polimorfo 1) y obtuvieron el polimorfo 2. Nosotros tenemos seis lugares o eventos diferentes en los que el “ejemplo 32” ha sido reproducido generando el polimorfo 2, no el polimorfo 1. ¿Cuál es la respuesta de Glaxo para esto? Semillas de cristales que están en el aire. No puedes verlas. No puedes olerlas. No puedes probarlas. Tampoco puede detectarlas, pero están allí, y esas semillas de cristales caen del cielo, y son muy inteligentes porque saben cuándo alguien está haciendo un experimento usando el “ejemplo 32”. Caen del cielo y caen en el vaso de precipitados haciendo que no se produzca el polimorfo 1, sino el polimorfo 2, y es por eso que cuando hoy realizamos este experimento obtuvimos como producto el polimorfo 2 y no el polimorfo 1... Bien, acepto que si uno cree en Santa Claus, también podríamos creer en estas semillas de cristales, pero si estamos más allá de eso, no vamos a creer en estas semillas de cristales, e incluso si fuera así, las técnicas que se utilizaron en estos experimentos, excluirían, sin ninguna duda, a estas semillas de cristales, porque las semillas de cristales, para sobrevivir al método que se ha utilizado en estos experimentos, tendrían que desafiar a los principios químicos".
Guerra de patentes
De lo anterior, surge otra pregunta interesante que tiene que ver con los derechos de patente. ¿Se pueden emitir patentes distintas para dos estructuras cristalinas diferentes de la misma sustancia? De hecho, esto sucedió con el clorhidrato de paroxetina, un medicamento para el tratamiento de la depresión. Tanto la compañía farmacéutica SmithKline Beecham (ahora GlaxoSmithKline) como la compañía Synthon tenían una patente para la misma sal de la paroxetina, pero posiblemente con diferente estructura cristalina. Aunque las dos patentes describen procedimientos muy similares para la síntesis del compuesto químico, se demostró que las sales obtenidas exhiben varias propiedades diferentes, por lo que fueron consideradas distintas entre sí por las autoridades emisoras de patentes. Se especuló que la primera patente se emitió para un polimorfo termodinámicamente inestable que puede desaparecer al transformarse en un nuevo polimorfo de la sal, dando así paso a la segunda patente. Este caso muy curioso, generó una batalla legal por años entre las dos compañías farmacéuticas involucradas, llegando incluso hasta la Corte Internacional de Justicia en La Haya.
Reproducir el fenómeno para entenderlo
Una de las piedras angulares de la investigación científica es la reproducibilidad de los resultados experimentales, es decir, un procedimiento experimental debe estar bien realizado y documentado para que pueda ser repetido por un laboratorio independiente en cualquier parte del mundo. En el caso de la desaparición de polimorfos, los límites de reproducibilidad se alcanzan fácilmente mediante la hipótesis de “siembra no intencional”. Si recordamos, la siembra no intencional o siembra involuntaria puede darse en el laboratorio, por la presencia de diminutas cantidades de un cristal que pueden caer, literalmente, en las soluciones preparadas para la cristalización, promoviendo así la formación de estructuras cristalinas no deseadas.
El problema es que las semillas plantadas sin intención, son solo una posible explicación de la observación de que una forma polimórfica desaparece y otra aparece. Como ya se mencionó, estas semillas son, por lo general, invisibles, no detectables e incluso prácticamente imposibles de remover de áreas específicas. Así pues, la existencia de estás semillas no está probada, pero basados en un razonamiento científico, deberían existir. Algo que debe estar ahí pero que nadie puede detectar suena como un gran misterio, y no solo es un problema para las autoridades emisoras de patentes.
La presencia de semillas o contaminantes desconocidos en un laboratorio, también ha tenido impacto en una de nuestras investigaciones recientes; específicamente nos referimos a los numerosos experimentos que realizamos en nuestro laboratorio sobre la cristalización de una sal inorgánica llamada clorato de sodio (ver nuestra contribución anterior “El extraño caso de los cristales diestros y siniestros”, http://www.acmor.org.mx/?q=content/el-extra%C3%B1o-caso-de-los-cristales-diestros-y-siniestros). En dicha contribución recopilamos varios casos extraños que ocurren en cristalizaciones y que todavía requieren una explicación concluyente. Una vía para encontrar esa explicación puede ser el polimorfismo, lo cual hemos notado recientemente y describimos a continuación.
El caso del clorato de sodio
El clorato de sodio muestra un aspecto interesante de polimorfismo. Primero cristaliza como un polimorfo metaestable (Forma 1), generando partículas cristalinas de tamaño nanométrico, y luego se transforma en cristales estables y visibles (Forma 2). Más aún, el polimorfo termodinámicamente estable, la Forma 2, puede crecer en dos configuraciones macroscópicas diferentes “cristales izquierdos” y “cristales derechos”, que se pueden distinguir haciendo pasar luz polarizada a través de ellos, un tipo de cristal hace girar la luz polarizada hacia la izquierda y el otro hacia la derecha.
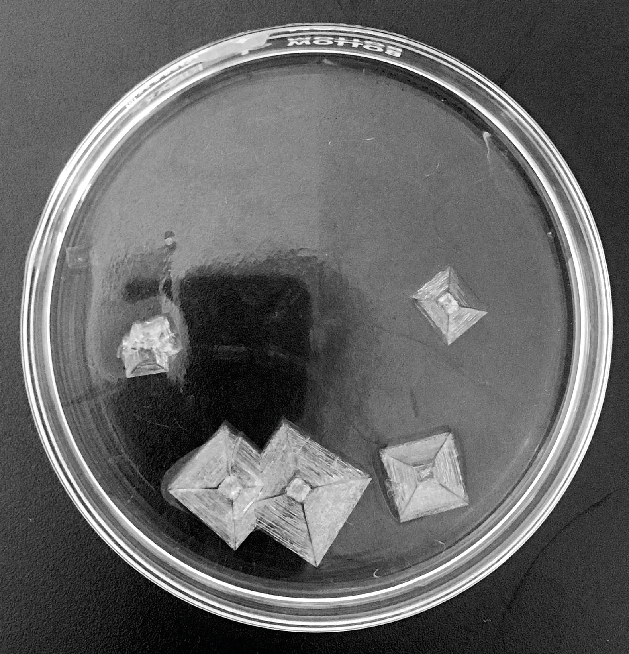
Figura 2. Cristales de clorato de sodio que crecieron durante un par de días en una caja de Petri. Cada monocristal puede ser zurdo o diestro. La quiralidad de cada cristal se puede distinguir fácilmente cuando la caja de Petri se coloca entre dos placas polarizadoras, y la luz pasa desde el fondo de la caja de Petri. Los cristales zurdos se tornan de un color diferente al color de los cristales derechos.
Esta propiedad de cristales diestros y siniestros, o hablando de manera general, de objetos diestros y siniestros, se denomina quiralidad. Los cristales zurdos y derechos tienen las mismas propiedades químicas y físicas y, por lo tanto, deberían generarse con la misma probabilidad, es decir, de 100 cristales formados, 50 deberían ser zurdos y 50 derechos. Cómo mencionamos, esta propiedad de izquierda y derecha solo se refiere a la estructura polimórfica estable (Forma 2) del clorato de sodio. Por el contrario, el polimorfo metaestable, Forma 1, consiste en cristales que no son quirales, es decir, no son diestros ni siniestros. Por lo anterior, la transformación de la Forma 1 a la Forma 2 conlleva una transición que va de estructuras no quirales a estructuras quirales. Recientemente se demostró que la transición puede ocurrir simplemente cuando los cristales de las Formas 1 y 2 se tocan entre sí. Por ejemplo, si un cristal zurdo de la Forma 2 toca a un cristal (nanométrico y no quiral) de la Forma 1, entonces el cristal de la Forma 1 se convierte en zurdo. Así que un pequeño toque es suficiente para marcar una gran diferencia o, en otras palabras, la cristalización del clorato de sodio revela un proceso de transición polimórfica muy sensible, considerando lo pequeño de la influencia: un solo toque.
Nuestros experimentos de cristalización mostraron algo inesperado: en lugar de obtener cristales de clorato de sodio diestros y siniestros en proporciones iguales (50:50) como se esperaba, siempre encontramos más cristales diestros que zurdos. De tal manera que parecía que esa parte faltante de cristales zurdos había desaparecido. Durante varios años realizamos un gran número de experimentos, limpiando cuidadosamente el laboratorio y purificando los compuestos químicos. Sin embargo, seguíamos observando la formación de más cristales diestros que siniestros; la observación persistió. Sorprendentemente, revisando la literatura científica, encontramos que esta observación también se ha dado en otros laboratorios en otras partes del mundo. ¿Hubo en algún momento alguna preferencia universal por la derecha sobre la izquierda? La respuesta no es fácil y aún permanece abierta. Sin embargo, podemos suponer que también los experimentos realizados en otras partes, se vieron afectados por el fenómeno de siembra no intencional, como en el caso del polimorfo que desapareció (Ritonavir). Al igual que en esos casos, nosotros no pudimos detectar o eliminar ese “algo” que supuestamente pudo infectar nuestro laboratorio; no teníamos idea de lo que estaba ocurriendo, de la misma manera en que Abbott Laboratories, la compañía productora del Ritonavir se refirió a su incidente: “No sabíamos qué lo causó, no sabíamos cómo prevenirlo y seguimos haciendo la pregunta, ¿por qué (ahora)?”. Para nuestro caso del clorato de sodio, podemos suponer que alguna contaminación de naturaleza física o biológica está causando la inesperada preferencia por los cristales diestros sobre los siniestros, tal vez esa preferencia tiene su origen en la sensible transición entre las formas polimorfas 1 y 2. Pero esto seguirá siendo solo una hipótesis hasta que se haya identificado y caracterizado la contaminación. La búsqueda de este “algo” continúa en nuestro laboratorio, así como en las grandes instalaciones de las compañías farmacéuticas que operan a nivel mundial, con el objetivo de prevenir nuevos casos como el del Ritonavir.
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos. Desde la Academia de Ciencias de Morelos externamos nuestra preocupación por el vacío que genera la extinción de la Secretaría de Innovación, Ciencia y Tecnología dentro del ecosistema de innovación estatal que se debilita sin la participación del Gobierno del Estado.
Referencias
D. K. Bučar et al., Disappearing Polymorphs Revisited. Angew. Chem. Int. Ed. 2015, 54, 6972-6993.
J. M. Cruz et al., Non-Stochastic Behavior in Sodium Chlorate Crystallization. Chirality 2020, 32, 120-134.









 Desarrollado por Linabat
Desarrollado por Linabat