Nitroplastos y diazoplastos, los nuevos organelos que surgieron de las aguas
David Romero Camarena
El Dr. David Romero es investigador del Centro de Ciencias Genómicas de la Universidad Nacional Autónoma de México, en Cuernavaca, Morelos. Su área de especialidad es la genómica bacteriana, con énfasis en mecanismos de cambio en genomas. Es miembro y expresidente de la Academia de Ciencias de Morelos.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
Unidos nos sostendremos, divididos caeremos.
No nos dividamos en facciones que destruirían
esa unión de la que depende nuestra existencia.
Patrick Henry (1736-1799)
Unidos nos sostendremos
Uno podría pensar que la competencia es una de las principales fuerzas en la evolución de la vida, pero esa es solo una simplificación. No niego que haya competencia de diferentes tipos, pero ese énfasis ignora el enorme papel que ha tenido la cooperación en la evolución; sí, cooperación para búsqueda de recursos, como en la cacería, agricultura y recolección; cooperación para la crianza de los individuos jóvenes y de sus propios grupos; cooperación para, como veremos más adelante, generar componentes celulares esenciales. Ignorar el papel de la cooperación en la evolución de las especies nos dejaría con una visión sesgada e incompleta de lo que es la vida.
La cooperación es, de hecho, central para entender el origen de la biodiversidad. La Tierra se formó hace 4 500 millones de años y las primeras formas de vida, los procariontes (organismos en los cuales el material genético está localizado en el citoplasma, por lo que carecen de un núcleo) aparecieron hace 3 500 millones de años. Estos organismos fueron los innovadores bioquímicos que contribuyeron a esculpir nuestro ambiente. Con la aparición de la fotosíntesis, en el grupo de las cianobacterias, se comenzó a aprovechar la energía solar para captar el carbono presente en el CO2, pudiéndose obtener así el elemento más abundante y esencial para la vida. La fotosíntesis tiene también como resultado la liberación de oxígeno, con lo que este gas pasó a ser un componente importante en la atmósfera. El oxígeno, si bien es necesario para la síntesis de moléculas orgánicas, puede ser también tóxico, y de hecho causó la extinción de muchas de las especies que existían hasta ese tiempo. Otro grupo de bacterias desarrolló la capacidad de respirar oxígeno y en el proceso generar el trifosfato de adenosina (ATP, por sus siglas en inglés). El ATP, debido a la alta cantidad de energía liberada con su hidrólisis, se convirtió en el facilitador que propulsa una amplia cantidad de reacciones químicas necesarias para la vida. Así, por casi 1 500 millones de años, los procariontes se convirtieron en la forma de vida predominante en la Tierra (1).
Hace 2 000 millones de años, hubo un cambio sustantivo en el tipo de organismos en nuestro planeta. Aparecieron los primeros eucariontes, organismos en los que, a diferencia de los procariontes, el material genético está separado del citoplasma en una estructura conocida como núcleo. Hay muchas teorías alternativas acerca de cómo se generó el núcleo, pero los pasos que llevaron a la mayor complejidad de los eucariontes están fuera de duda. Gracias al trabajo pionero de Lynn Margulis, publicado en 1967 y complementado en 1981 (2), ahora sabemos que los eucariontes empezaron a desarrollar la cooperación para expandir sus capacidades bioquímicas. La teoría de Margulis postula que los eucariontes ancestrales comenzaron a establecer asociaciones cooperativas (simbióticas) con bacterias capaces de usar el oxígeno para sintetizar ATP. Estas asociaciones, tal vez pasajeras en un principio, al ser tan exitosas dieron lugar a asociaciones más estrechas. Las bacterias que respiraban el oxígeno invadieron, literalmente, al eucarionte ancestral. Esto podría haber derivado en un parasitismo, pero afortunadamente siguieron el camino de cooperación. El eucarionte ancestral ganaba mucho adquiriendo la capacidad de respirar oxígeno y producir ATP, mientras que el procarionte invasor, si bien limitaba su capacidad de crecimiento para hacerla compatible con la del eucarionte ancestral, ganaba un ambiente rico en nutrientes y protegido de competencia y predadores. Para estabilizar esta relación, el procarionte invasor comenzó a perder grandes segmentos de su genoma original, innecesarios ahora para sintetizar compuestos provistos por el eucarionte ancestral. Además, el eucarionte ancestral no solo proveía nutrientes, sino que también completaba reacciones bioquímicas necesarias para el mantenimiento del procarionte ancestral. La teoría de Margulis, ampliamente aceptada, se conoce como teoría de la endosimbiosis serial (Figura 1) y es una explicación clara y elegante sobre cómo se originó en la célula el organelo que ahora distinguimos como responsable de respiración y producción de ATP, denominado como mitocondria. La mitocondria está presente en todos los eucariontes que, como los humanos, respiramos oxígeno. Sí, nuestras mitocondrias tienen un lejano origen procarionte. Esto es lo que explica por qué un tratamiento excesivamente prolongado con antibióticos puede afectar a las células eucariontes. Los antibióticos en principio atacan solamente a células procariontes, como las bacterias. Pero dado el origen procarionte de las mitocondrias, un tratamiento excesivamente prolongado puede atacarlas también. ¡Una razón más para no abusar de los antibióticos!
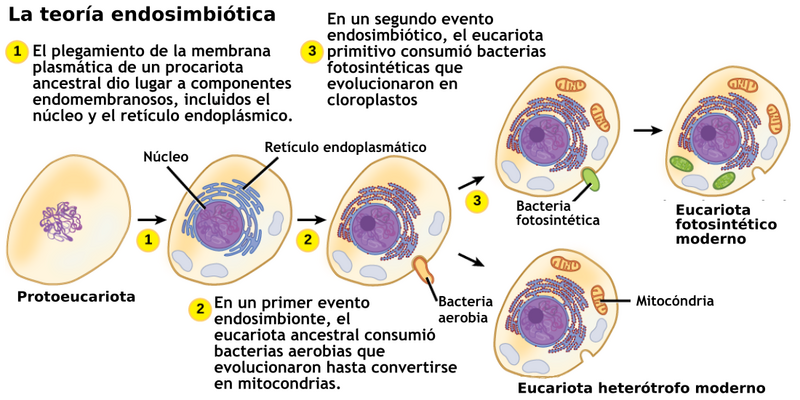
Figura 1. Teoría Endosimbiótica Serial
Imagen tomada de https://es.wikipedia.org/wiki/Endosimbiosis_seriada
Bueno, si la endosimbiosis ya funcionó una vez en la evolución ¿no podría establecerse otra vez con otro procarionte para aumentar alguna otra capacidad de los eucariontes? Eso es lo que planteó nuevamente Margulis para explicar el origen de eucariontes que, como las plantas, respiran y además son capaces de realizar fotosíntesis. La propuesta, también ya ampliamente aceptada, es que hace 1 500 millones de años un eucarionte que ya poseía mitocondrias, es decir, que ya respiraba, estableció una segunda relación endosimbiótica con una cianobacteria capaz de realizar fotosíntesis. Eso es lo que explica la generación de otro organelo, el cloroplasto (Figura 1). Los cloroplastos actuales, al igual que las mitocondrias, tienen todas las señales de haberse generado por endosimbiosis: poseen un genoma muy reducido, se reproducen en consonancia con el eucarionte que los aloja y establecen una cooperación bioquímica con el eucarionte para realizar sus funciones.
Y ¿qué pasa con el nitrógeno?
Como sabemos, los procariontes establecieron reacciones bioquímicas esenciales para poder asimilar los cuatro elementos químicos mayoritarios para la vida (carbono, hidrógeno, oxígeno y nitrógeno). La fotosíntesis lleva a la asimilación del carbono en el CO2 y a su transformación en moléculas orgánicas empleando la energía del sol, al mismo tiempo que el oxígeno es asimilado y detoxificado, y la energía liberada de la oxidación es almacenada en forma de ATP. Finalmente, el hidrógeno es adquirido a través de múltiples reacciones que tienen su origen en el agua. Pero ¿qué pasa con el nitrógeno? La mayor fuente de nitrógeno en la Tierra no está en la corteza terrestre, sino en la atmósfera. Sí, nuestro aire está compuesto en un 78% por N2. ¡Pero se necesita en la corteza terrestre y también en los cuerpos de agua, incluyendo los océanos!
Nuevamente, la capacidad para convertir el nitrógeno del aire en compuestos asimilables por los seres vivos, ese fenómeno que conocemos como la fijación de nitrógeno, se lo debemos y se lo seguimos debiendo también a los procariontes. Varios tipos de procariontes, incluyendo bacterias, cianobacterias fotosintéticas y aún arqueas producen la enzima nitrogenasa, capaz de tomar el nitrógeno en su forma de elemento inerte en el aire y convertirlo en amonio, un compuesto orgánico asimilable por los seres vivos. Los procariontes que tienen esta capacidad, se dice que “fijan nitrógeno”, sinónimo de “hacerlo disponible para la vida”, para así poder emplearlo para su crecimiento y reproducción. Pero no solo eso, al morir, dejan el nitrógeno “fijado” accesible para otros seres vivos, incluyendo eucariontes, que al recibirlo así ya no requieren hacer el proceso de fijación.
Algunos fijadores de nitrógeno han establecido relaciones laxas con otros eucariontes, como las plantas, tan laxas que permiten que cada integrante de la asociación mantenga su independencia (sin duda una asociación virtuosa). Otros más, como las bacterias del género Rhizobium y especies relacionadas (ampliamente estudiadas en el Centro de Ciencias Genómicas en Cuernavaca), establecen relaciones simbióticas muy específicas con plantas leguminosas, como el frijol, el chícharo y otras plantas en donde las semillas están encerradas en vainas, como el guaje. En estas relaciones simbióticas, Rhizobium invade las raíces de las plantas, formando estructuras esféricas conocidas como nódulos, en donde las células de Rhizobium fijan nitrógeno, donándole una parte a la planta y recibiendo a cambio compuestos de carbono necesarios para su supervivencia. Sí, es una relación simbiótica, pero no tan estrecha como para haber culminado en una endosimbiosis que generara un organelo fijador de nitrógeno.
En el mar, la vida es más sabrosa… ¿o no?
Dada la importancia vital de la fijación de nitrógeno en la agricultura, los estudios sobre fijación de nitrógeno eran muy amplios y detallados en ambientes terrestres, pero no se habían enfocado a ambientes acuáticos, como los oceános, donde comenzaron apenas hace unos treinta años. En ese entonces se pensaba que un procarionte, la cianobacteria filamentosa Trichodesmium, era la principal responsable de la fijación de nitrógeno en ambientes marinos. Cuando el grupo de Jonathan Zehr, en E.E. U.U. comenzó en el año 2000 a estudiar ambientes marinos, estuvieron dedicados a verificar si esta idea era cierta. Empleando filtración a alta presión de agua de mar y verificando en qué fracción de tamaño se encontraba evidencia de fijación de nitrógeno, pudieron verificar que las largas células de Trichodesmium fijaban nitrógeno, pero que también lo hacían células más pequeñas de una cianobacteria unicelular, e inclusive en una mayor magnitud (3). Estudios posteriores confirmaron este hallazgo, nombrando a esta cianobacteria unicelular, no cultivable en el laboratorio, como Candidatus Atelocyanobacterium thalassa, o UCYN-A.
Hasta ese momento, se pensaba que UCYN-A fijaba nitrógeno actuando como una cianobacteria independiente, sin asociarse con ningún otro organismo. Sin embargo, dos hechos cambiaron radicalmente esta concepción. Uno de ellos implicó un esfuerzo, técnicamente muy complejo debido a la incapacidad de cultivar UCYN-A, para obtener la secuencia completa de su genoma. El dato, sorprendente en su momento, mostró que poseía un genoma muy reducido, equivalente a tan solo un tercio del tamaño del genoma observado en otras cianobacterias. Si bien se encontraron en este genoma los genes necesarios para fijación de nitrógeno, faltaban los genes necesarios para hacer fotosíntesis, para el ciclo de Krebs y para síntesis de algunos aminoácidos y nucleótidos, funciones vitales para la célula. Estas ausencias explicaban la incapacidad para cultivarlo en laboratorio y hacían sospechar que UCYN-A tenía que establecer una cooperación estrecha con otro organismo que proveyera los componentes faltantes.
Con esta idea en mente, emplearon en lugar de filtración a alta presión, técnicas más suaves para separar a UCYN-A del resto de las células. Al hacer esto, encontraron que UCYN-A siempre se encontraba asociado con células de un eucarionte, el alga fotosintética unicelular Braarudosphaera bigelowii, un componente del fitoplancton ampliamente distribuido en los océanos (4). Esta alga eucariótica pertenece al orden de los Coccosphaerales y tiene una estructura muy llamativa. Al menos en algunas fases de su ciclo de vida, está cubierta de placas calcáreas con una estructura pentagonal, formando en su conjunto un dodecahedro (Figura 2). Las grandes carencias en el genoma de UCYN-A, incompatibles con una vida autónoma, y su asociación invariable con B. bigelowii, sugerían la posibilidad de una estrecha asociación simbiótica obligada entre una cianobacteria y un alga eucarionte fotosintética.

Figura 2. Braarudosphaera bigelowii. A-C, imágenes por microscopía electrónica de barrido. D-F, imágenes por microscopía óptica.
Imagen tomada de https://en.wikipedia.org/wiki/Braarudosphaera_bigelowii
Nuevos organelos: el nitroplasto y el diazoplasto.
¿Qué tan estrecha es esta asociación? Los datos sugerían la posibilidad de una endosimbiosis, debido a que las imágenes de microscopía electrónica de B. bigelowii mostraban un cuerpo esférico que podría corresponder a un nuevo organelo. La constatación de que ciertamente lo es fue publicada hace apenas tres semanas (Figura 3). El grupo de J. Zehr logró cultivar a B. bigelowii en el laboratorio y empleando técnicas de microtomografía lograron obtener imágenes del cuerpo esférico, mostrando su localización celular y siguiendo su división a lo largo del crecimiento. Como era de esperarse tratándose de un organelo, su división es sincrónica con el resto de los componentes celulares (5). Mostraron también que el cuerpo esférico contiene el genoma de UCYN-A. Pero para poder decir que es un nuevo organelo formado por endosimbiosis, era necesario mostrar cooperación metabólica. Datos previos de este laboratorio ya habían mostrado que B. bigelowii podía realizar fotosíntesis (una función de la que es incapaz UCYN-A) y que también podía realizar fijación de nitrógeno (función que solo puede realizar UCYN-A).

Figura 3. Portada de la revista Science del 12 de abril de 2024, en la que se describe el nitroplasto.
En este trabajo (5) mostraron también que proteínas codificadas en el núcleo de B. bigelowii son sintetizadas en el citoplasma y transportadas al cuerpo esférico. En una clara demostración de cooperación intracelular, las proteínas transportadas al cuerpo esférico son esenciales para la bacteria, ya que le permiten completar la biosíntesis de aminoácidos y nucleótidos en el cuerpo esférico, dan lugar a una mejor provisión de energía para la nitrogenasa, además de conferirle una mejor protección a oxígeno, al cual la nitrogenasa es muy sensible. Estos datos demuestran contundentemente que se ha encontrado un nuevo organelo especializado en la fijación de nitrógeno en un eucarionte, originado por endosimbiosis, llamado nitroplasto (Figura 4). Por comparación de secuencia del genoma de UCYN-A, se ha podido fechar el origen de este organelo a hace solo 100 millones de años. Se trata así de un organelo “joven” en términos evolutivos.

Figura 4. El nitroplasto. Imagen tomada de https://www.illustrative-science.com
Si el descubrimiento de un nuevo organelo en un eucariote, especializado en fijación de nitrógeno es un evento científico espectacular y de gran impacto ¿que tal que hubieran dos o más? En un estudio actualmente en prensa, el grupo de Ellen Yeh en E.E. U.U. describe una diatomea de agua dulce, llamada Epithemia clementina, la cual alberga un endosimbionte con la capacidad de fijar nitrógeno (6). El endosimbionte es nuevamente una cianobacteria, pero no relacionada a UCYN-A sino a otra cianobacteria llamada Crocosphaera subtropica. El genoma de este endosimbionte ha perdido los genes necesarios para fotosíntesis, pero retiene los necesarios para fijación de nitrógeno. Muestran también la existencia de una codependencia metabólica entre el huésped y el endosimbionte. Aunque aún faltan datos referentes a la coordinación de la división del endosimbionte y del eucarionte huésped, los datos son lo suficientemente convincentes para sugerir un organelo, que los autores han denominado diazoplasto.
Lo descubierto hasta este momento es muy emocionante. No todos los días se descubren nuevos organelos. Descubrir dos, de orígenes independientes, confiriendo la capacidad de fijar nitrógeno, constituye un hecho histórico en la biología. A Lynn Margulis le hubiera encantado, sobre todo porque muestran que la endosimbiosis serial no se detuvo hace miles de millones de años, sino que se ha mantenido hasta épocas recientes. ¿Por qué no se habían descubierto antes? Las respuestas pueden ser muchas, pero ciertamente pueden involucrar que nuestro conocimiento de la biodiversidad es aún fragmentario, que se requiere mayor esfuerzo en investigación básica y que es importante una investigación dedicada y constante en ambientes nuevos, como los oceános y los ríos, por mencionar algunos.
Lo que es importante de mencionar también es el potencial aplicado de estos descubrimientos. Uno de los intereses más importantes en el campo de la fijación de nitrógeno es transferir esta capacidad a plantas que no establecen asociaciones con fijadores de nitrógeno, como el maíz y el trigo, volviéndolas así independientes de la necesidad de fertilizantes nitrogenados. Hasta ahora, las propuestas involucraban la inclusión de estos genes en un organelo ya existente en estas plantas, como la mitocondria. El descubrimiento de los nitroplastos y los diazoplastos nos indica que la naturaleza encontró una alternativa diferente a la concebida por los investigadores: la generación de nuevos organelos fijadores de nitrógeno. Cómo se lograron estas adaptaciones y con qué organismos serán campos de estudio muy importantes en el futuro inmediato.
Referencias
1) Dunn, Michael (2024). Hacia la comprensión del origen de la vida en la Tierra. https://acmor.org/publicaciones/hacia-la-comprensi-n-del-origen-de-la-vida-en-la-tierra
2) Endosimbiosis seriada. https://es.wikipedia.org/wiki/Endosimbiosis_seriada
3) Zehr, J. P. et al. Unicellular cyanobacteria fix N2 in the subtropical North Pacific Ocean. Nature 412, 635–638 (2001).
4) Thompson, A. W. et al. Unicellular Cyanobacterium Symbiotic with a Single-Celled Eukaryotic Alga. Science 337, 1546–1550 (2012).
5) Coale, T. H. et al. Nitrogen-fixing organelle in a marine alga. Science 384, 217–222 (2024).
6. Moulin, S. L. Y. et al. The endosymbiont of Epithemia clementina is specialized for nitrogen fixation within a photosynthetic eukaryote. ISME Commun. ycae055 (2024) doi:10.1093/ismeco/ycae055.
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos. Desde la Academia de Ciencias de Morelos externamos nuestra preocupación por el vacío que genera la extinción de la Secretaría de Innovación, Ciencia y Tecnología dentro del ecosistema de innovación estatal que se debilita sin la participación del Gobierno del Estado.











 Desarrollado por Linabat
Desarrollado por Linabat