Baterías y limones, ¿tienen algo en común?
Jeannete Ramírez Aparicio, Lorena Magallón Cacho, Edgar Jesús Borja Arco y P.J.Sebastian
Las doctoras Jeannete Ramírez y Lorena Magallón son catedráticas CONACYT, investigadoras por México, en el Centro de Investigación en Ingeniería y Ciencias Aplicadas CIICAp de la Universidad Autónoma del Estado de Morelos.
El doctor Edgar Jesús Borja es investigador del Departamento de Física y Química Teórica, Facultad de Química, Universidad Nacional Autónoma de México (UNAM).
El doctor P. J. Sebastian es investigador del Instituto de Energías Renovables, UNAM.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
¿Qué es una batería?
Las baterías, comúnmente llamadas pilas eléctricas, son dispositivos que transforman la energía química de los compuestos que lo conforman, en energía eléctrica. Sin duda alguna, su uso está implícito en la gran mayoría de los dispositivos eléctricos y electrónicos que usamos a diario, tales como: lámparas, relojes, celulares, computadoras portátiles, tabletas electrónicas, automóviles, etc. Y si bien, forman parte de nuestra vida diaria, rara vez nos cuestionamos sobre su origen, funcionamiento o sobre los diferentes tipos de baterías que existen. Así que, para ponernos al corriente con estos hechos, debemos conocer primero a dos personas muy importantes que marcaron la historia de la humanidad con sus descubrimientos, y cuyas contribuciones permitieron entender la forma en que se llevaban a cabo los fenómenos eléctricos, estamos hablando de Luigi Galvani y Alessandro Giuseppe Antonio Anastasio Volta, ¿habías escuchado de ellos?
El origen de las baterías
El descubrimiento de las baterías tiene su origen en 1780 con la investigación del médico, fisiólogo y físico italiano, Luigi Galvani. Él observó el movimiento de un anca de rana al colocar dentro del músculo dos metales diferentes, a este efecto lo llamó: “electricidad animal”. El físico italiano Alessandro Giuseppe Volta se interesó en los experimentos de Galvani, él estaba convencido que no era necesario un tejido animal para la obtención de una corriente eléctrica, por lo que comenzó a realizar experimentos con diferentes metales que lo condujeron a desarrollar la pila eléctrica. (Figura 1). En el año de 1800, Volta dio a conocer su famoso invento: la pila de Volta. Esta consistió en apilar discos de cobre y zinc de igual tamaño alternando entre ellos un paño húmedo con una disolución salina. Con este experimento Volta logró convertir la energía química en energía eléctrica. Hoy en día todos conocemos la unidad eléctrica “volt” la cual fue nombrada en su honor [1].
 Figura 1. L. Galvani (1737-1798) y A. Volta (1745-1827).
Figura 1. L. Galvani (1737-1798) y A. Volta (1745-1827).
¿Cómo está compuesta una batería?
Cuando observamos una batería o pila de forma cilíndrica (Figura 2), lo primero que vemos es un contenedor de lámina de acero recubierto por un polímero y, es dentro de esta estructura, que se localizan los componentes básicos que la constituyen. Al interior de ella, encontraremos los siguientes elementos: un ánodo, el cual es el material que aporta los electrones, por tanto, se oxida (cubierta de Zinc); un cátodo, el cual es el material que va a ganar electrones y por tanto se reduce (barra de grafito); un electrolito, que se comporta como un conductor iónico debido al libre flujo de iones. Sin embargo, para hacer uso de la corriente eléctrica de la batería, es necesario cerrar el circuito, conectando el cátodo y el ánodo para que los electrones que cede el ánodo sean llevados al cátodo. En un caso práctico, esto sucede cuando usamos, por ejemplo, una batería en una lámpara portátil y la encendemos.
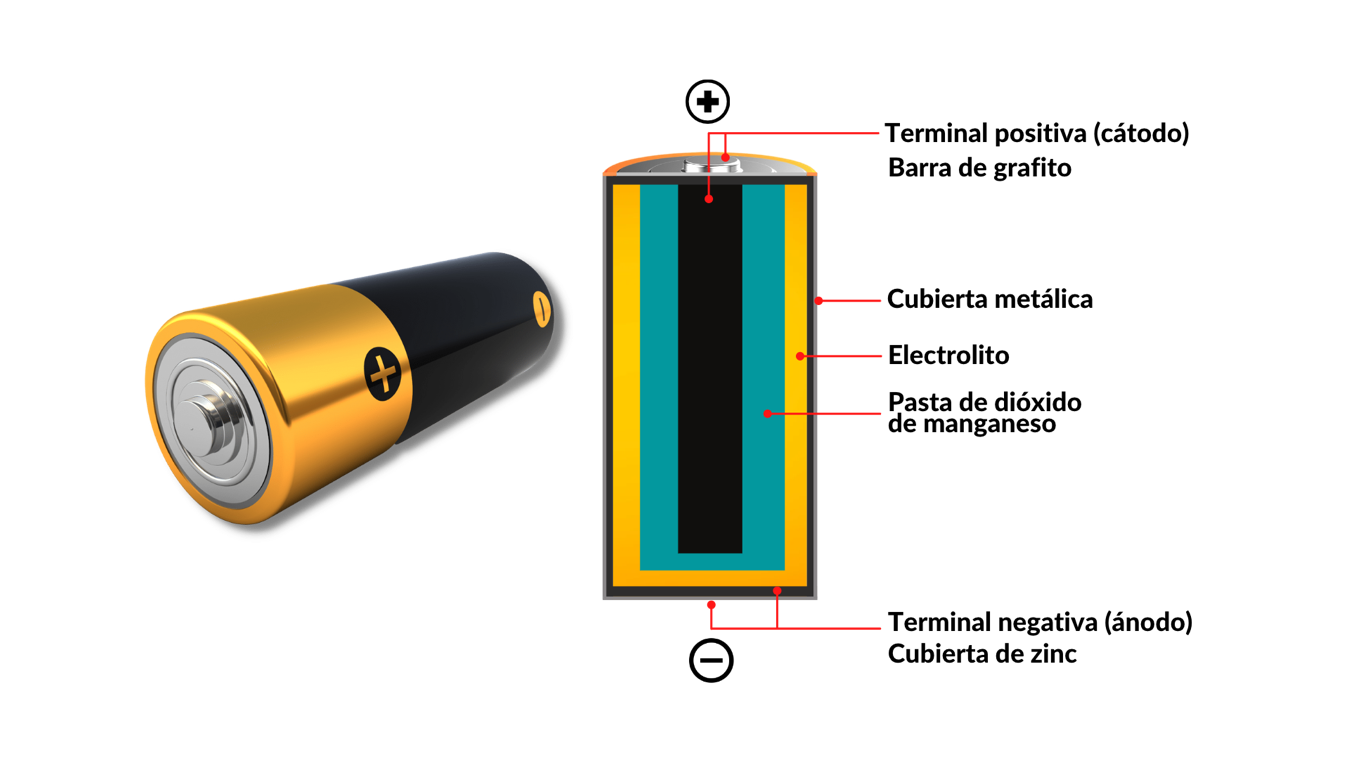 Figura 2. Estructura convencional de una batería o pila seca.
Figura 2. Estructura convencional de una batería o pila seca.
¿Por qué existen baterías que puedes cargar y descargar? ¿Por qué otras son de un solo uso?
Las respuestas a estas preguntas se encuentran en el tipo de reacciones químicas que suceden en los electrodos de la batería. Existen diferentes formas y tamaños de pilas, las cuales se pueden clasificar de acuerdo con sus constituyentes químicos (materiales de composición) y aplicación [2]. Sin embargo, para diferenciarlas de una forma sencilla podemos identificarlas como baterías no recargables y recargables, es decir, celdas primarias y celdas secundarias, respectivamente. Las celdas primarias son aquellas baterías no recargables (pilas secas), de un solo uso, las cuales producen energía eléctrica mediante una reacción química irreversible y dejarán de producir electricidad cuando el ánodo agote sus electrones quedando oxidado y el cátodo reducido. Por otro lado, las celdas secundarias son baterías que podemos usar varias veces, debido a que las reacciones que ocurren son reversibles, es decir, es posible recargarlas. Esto se puede lograr suministrando corriente eléctrica (de manera externa) hacia la batería, lo que regenerará a los reactivos a su estado original, de tal forma que la batería quedará lista para ser utilizada de nuevo.
¿Es posible hacer una batería con un limón?
La respuesta a esta pregunta es que sí es posible. Podemos hacer una batería orgánica con un limón y otros materiales que seguramente tienes en casa. ¿Qué materiales ocupas para hacerlo? Necesitarás lo siguiente: un limón, el zumo ácido del limón actuará como un electrolito, la sustancia que transporta los iones entre los electrodos; un clavo o tornillo de acero galvanizado con una cubierta de zinc (ánodo); un clavo o tornillo, moneda o alambre, cualquiera que elijas es importante que sea de cobre (cátodo); un multímetro con cables y puntas, para medir la diferencia de potencial.
 Figura 3 Representación gráfica de una batería orgánica y un multímetro.
Figura 3 Representación gráfica de una batería orgánica y un multímetro.
Lo primero por hacer es insertar dentro del limón el material de cobre que elegiste, este electrodo será el cátodo. Ahora deberás insertar el clavo o tornillo galvanizado al otro lado del limón, este será el ánodo. Es muy importante que ambos metales no se toquen, debe quedar una separación entre ellos. Ya está lista la batería, vamos a medir la diferencia de potencial o voltaje con ayuda del multímetro (Figura 3). Lo primero por hacer es colocar la punta del cable rojo (terminal positiva) del multímetro al electrodo de cobre y colocar la punta del cable negro (terminal negativa) al electrodo de zinc, y observaremos que el voltaje que nos da la batería orgánica se encuentra alrededor de 0.9 volts. El voltaje de tu pila orgánica es muy pequeño, por lo que si tú necesitas aumentar el voltaje, por ejemplo, a 1.5 volts para hacer funcionar una calculadora, tendrás que hacer otra pila de limón y conectarlas en serie como se observa en la Figura 4.
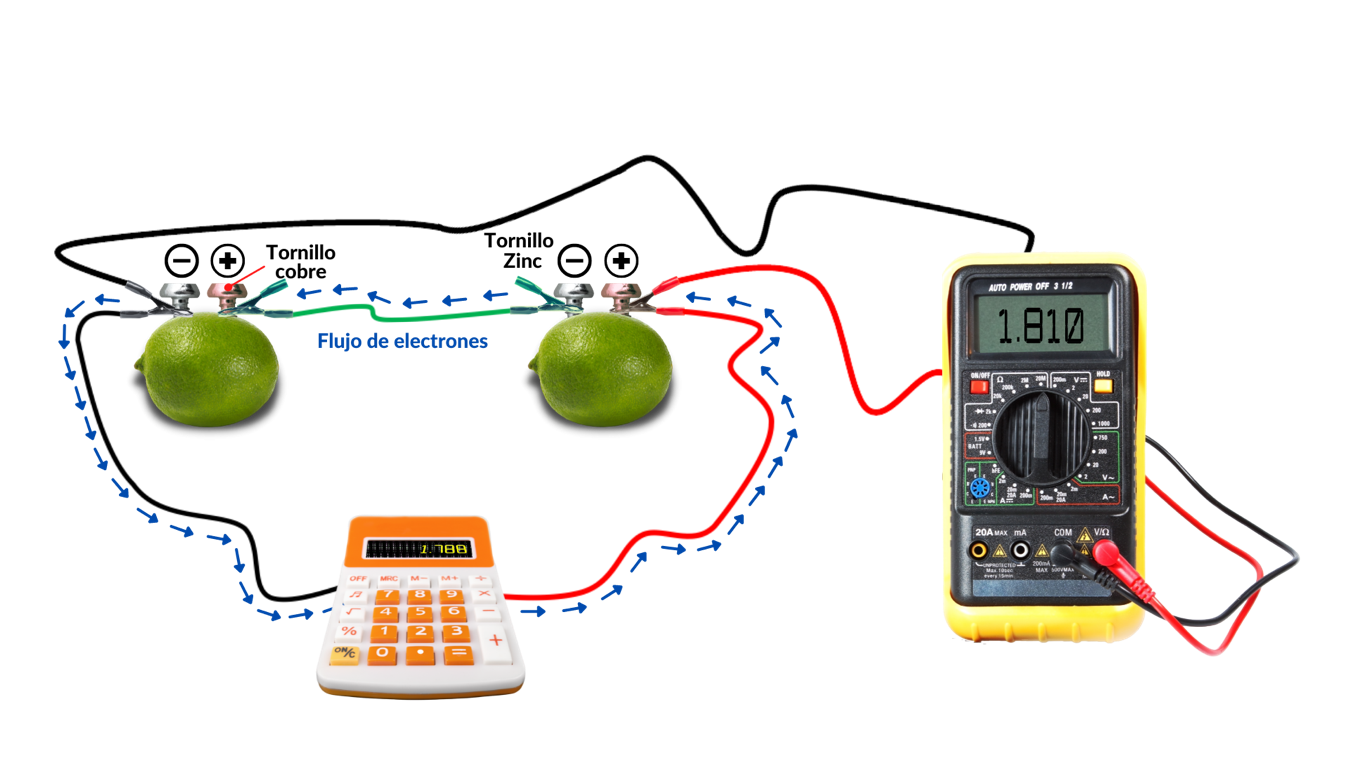 Figura 4. Representación gráfica de baterías orgánicas conectadas en serie.
Figura 4. Representación gráfica de baterías orgánicas conectadas en serie.
La corriente eléctrica se genera debido a la reacción química que sucede entre el ácido cítrico del limón y los elementos metálicos que se encuentran al interior de este, produciéndose electrones. El tornillo de zinc se oxida y actúa como ánodo, mientras que el material de cobre se reduce y actúa como cátodo. Al cerrar el circuito, uniendo ánodo y cátodo, usando un cable conductor, comienza el flujo de estos electrones, generando corriente eléctrica debido a la diferencia de potencial que existe entre ellos.
Conclusión
Sin duda alguna, el desarrollo científico de las baterías modernas no habría sido posible sin las observaciones de Galvani y los estudios realizador por Alessandro Volta para el desarrollo de la pila eléctrica, siendo un parteaguas en todo lo que hoy conocemos. Las pilas nos permiten almacenar y después suministrar energía eléctrica para el funcionamiento de diferentes tipos de dispositivos, por ejemplo, los teléfonos celulares, tabletas, relojes, que podemos tenerlos encendidos por horas e incluso días. Experimentos sencillos como este, te acercan a la comprensión de fenómenos que ocurren en nuestro día a día. Este experimento lo puedes realizar no solamente con limones, inténtalo usando diferentes verduras o frutas y descubre qué voltaje se obtiene.
Referencias
[1] https://batteryuniversity.com/article/bu-101-when-was-the-battery-invented
[2] https://energizer.lat/Mexico/como-funcionan-las-baterias/
Fecha de última consulta: 11 de diciembre de 2022
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos. Desde la Academia de Ciencias de Morelos externamos nuestra preocupación por el vacío que genera la extinción de la Secretaría de Innovación, Ciencia y Tecnología dentro del ecosistema de innovación estatal que se debilita sin la participación del Gobierno del Estado.







 Figura 1. L. Galvani (1737-1798) y A. Volta (1745-1827).
Figura 1. L. Galvani (1737-1798) y A. Volta (1745-1827). Figura 2. Estructura convencional de una batería o pila seca.
Figura 2. Estructura convencional de una batería o pila seca. Figura 3 Representación gráfica de una batería orgánica y un multímetro.
Figura 3 Representación gráfica de una batería orgánica y un multímetro. Figura 4. Representación gráfica de baterías orgánicas conectadas en serie.
Figura 4. Representación gráfica de baterías orgánicas conectadas en serie. Desarrollado por Linabat
Desarrollado por Linabat