El Zinc: El metal más versátil
Georgina Hernández Montes
RAI-UNAM
La Dra. Georgina Hernández Montes es Química Farmacobióloga egresada de la Facultad de Química de la UNAM. Actualmente es parte de la Red de Apoyo a la Investigación (RAI) de la UNAM y se ha especializado en el área de bioinformática.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
La Asamblea General de las Naciones Unidas declaró al 2019 como el año internacional de la tabla periódica de los elementos químicos debido a que este año se conmemora el 150 aniversario su creación por parte del científico ruso Dmitri Mendeléyev. Es por ello que, a lo largo del año, en esta columna dedicamos vario números a explicar la importancia de los diferentes elementos químicos en nuestra vida diaria. En esta ocasión y para cerrar este ciclo de columnas hablaremos del Zinc que es otro de los elementos esenciales para la vida.
La palabra "zinc" viene del alemán zink que en español puede traducirse como pico o diente y tiene mucho que ver con la apariencia del mineral. Es un metal color blanco azulado, que en contacto con el aire arde produciendo una llama verde azulada. Esta característica hace que se encuentre en combinación con otros elementos, los más comunes son el sulfuro de zinc (ZnS) que comúnmente se llama esfalerita, la smithsonita que es carbonato de zinc (ZnCO3) y la hemimorfita, que es un silicato de zinc (Zn4Si2O7(OH)2·H2O).
Es el 23° elemento más abundante en la corteza terrestre, está en la familia de los elementos que se denominan metales de transición y la característica principal de estos elementos es que pueden ser estables por sí mismos sin necesidad de una reacción con otro elemento, pero el zinc no es estrictamente un metal de transición. Este elemento tiene el número atómico 30, un peso atómico de 65.38 y un estado de oxidación +2, lo que significa que tiene una gran tendencia a donar electrones cuando se combina con otros elementos (Figura 1).

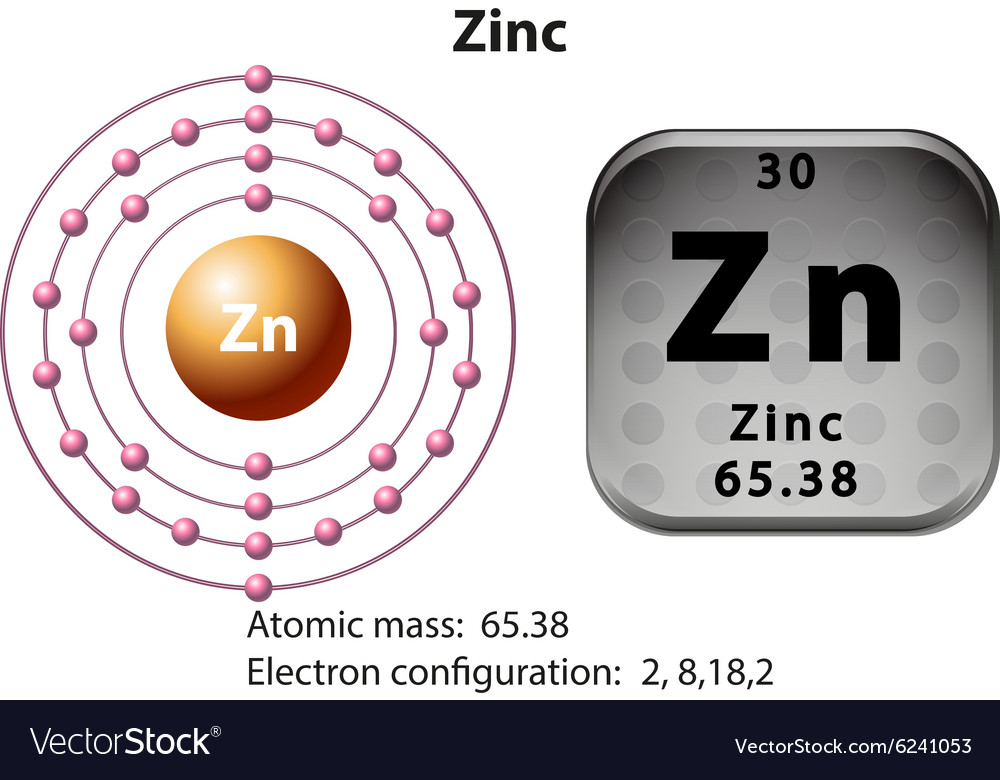
Figura 1. Símbolo y configuración electrónica del zinc. Tomada de https://www.vectorstock.com/royalty-free-vector/symbol-and-electron-diagram-for-zinc-vector-6241053
Un poco de historia
El uso de aleaciones con zinc es muy antiguo, la más común es el latón que es una combinación entre calamina (una fuente importante de zinc) y cobre. Las piezas más antiguas datan de piezas de los años 1000-1500 a. C. s en Canaán. Otros objetos con alto contenido de zinc también han sido encontrados en la antigua región de Transilvania. Gracias a algunos registros se sabe que los romanos también fabricaron latón ya que en el año 30 a. C. Plinio y Dioscórides describe el procedimiento para la obtención de aurichalcum que es como se conocía al latón mediante el calentamiento en un crisol de una mezcla de cadmia (calamina) con cobre para fabricar objetos. En la India gracias a la obra Rasarnava que data del año 1200 de nuestra era también se conoce el procedimiento que utilizaban para la fundición y extracción de zinc impuro.
Por muchos siglos se desconoció que el zinc era un metal diferente, se propone que Paracelso el famoso alquimista, médico y astrólogo austriaco que vivió entre 1493 y 1541 fue el primero en sugerir que el zincum era un nuevo metal y que sus propiedades diferían de las de los metales conocidos. Y no fue sino hasta 1742 que el zinc fue aislado por primera vez por el químico Anton von Swab y posteriormente por el químico Andreas Marggraf, quien repitió y documentó ampliamente el proceso en 1746, considerándose su trabajo como el inicio de la metalurgia del zinc.
En 1743 se fundó en Bristol el primer establecimiento para la fundición del metal a escala industrial, pero fue hasta 1813 que se desarrolló un procedimiento para su extracción y se estableció la primera fábrica en el continente europeo.
Aplicaciones
La aplicación más importante del zinc es en el galvanizado del acero para protegerlo de la corrosión. Este recubrimiento tiene la capacidad de protegerlo aun cuando se generen grietas en el mismo. Otro de los usos populares es en las baterías para computadoras, que se denominan de zinc-aire y cuya característica principal es que se lleva a cabo una reacción de oxidación del zinc con el oxígeno del aire. También tiene un papel fundamental en la industria aeroespacial para la fabricación de misiles y cápsulas espaciales. También se utiliza mucho en la fabricación de maquinaria, vehículos y componentes electrónicos. Finalmente, uno de los usos poco relacionados a los anteriores, es como ingrediente en la industria cosmética ya que se usa como un agente para dar volumen y como coloración en algunos productos, e incluso se usa como protector de la piel y como bloqueador solar. En la Figura 2 se ilustra el porcentaje de usos para el zinc.

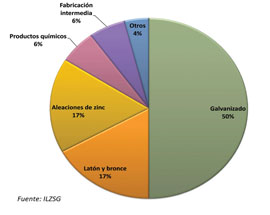
Figura 2. Ilustración de las aplicaciones y usos del zinc. Tomada de https://www.azsa.es/es/CalidadyProductos/todo-sobre-el-zinc/Paginas/Principales-Aplicaciones-del-Zinc.aspx
El zinc en la alimentación
Las principales fuentes de zinc en la dieta son las proteínas de origen animal. Las carnes de res, cerdo y cordero contienen mayor cantidad de zinc que el pescado mientras que la carne oscura de un pollo contiene más cantidad de zinc que la carne blanca. Otras fuentes buenas de zinc son las nueces, los granos enteros, las legumbres y la levadura.
Las frutas y las verduras no son buenas fuentes, porque el zinc en las proteínas vegetales no está tan disponible para el consumo humano como el zinc de las proteínas animales. Por lo tanto, las dietas bajas en proteínas y las dietas vegetarianas tienden a ser bajas en zinc. Los multivitamínicos y suplementos alimenticios también tienen cantidades importantes de zinc en forma de sulfatos, acetatos o gluconatos. Así mismo algunos medicamentos como pastillas, aerosoles y geles nasales para resfriados también contienen zinc. Por lo que si se mantiene una dieta adecuada se pueden mantener sin ningún problema las concentraciones adecuadas de zinc en el organismo.
El zinc dentro del cuerpo humano
El zinc es un elemento esencial para todos los seres vivos y en los humanos es el segundo elemento más importante en sus procesos biológicos después del hierro. Está presente en todos los tejidos y secreciones corporales en concentraciones relativamente altas. El 85% se encuentra en los músculos y huesos, el 11% en la piel y el hígado, y el resto en otros tejidos siendo las concentraciones más altas en la próstata y el ojo. El contenido total de zinc del plasma suele ser de aproximadamente 100 g de zinc por cada 100 ml de plasma, dependiendo de la edad, el sexo, la hora del día y si hay un embarazo.
A nivel molecular el zinc protege a las estructuras biológicas del daño causado por los radicales libres mediante diferentes mecanismos. Por ejemplo, es un componente esencial de la superóxido dismutasa, una proteína que funciona como un agente protector para los tioles.
El zinc tiene varias funciones específicas (Figura 3) en las proteínas que realizan funciones químicas en (enzimas) en los organismos. El papel catalítico significa que el metal está directamente involucrado en las reacciones enzimáticas es decir en las transformaciones mediadas por enzimas. Si algún agente elimina los iones de zinc, las enzimas pierden sus propiedades catalíticas. Típicamente, el átomo de zinc está unido a tres o cuatro ligandos, que comprenden aminoácidos, siendo la histidina la más frecuente, seguida de ácido glutámico, ácido aspártico y cisteína. Cuando participa como co-catalizadores puede estar presente o no en una enzima, ya que no son indispensables la actividad enzimática ni para la estabilidad. Finalmente, cuando participa como un factor estructural, mantienen la estructura de las diferentes proteínas para que esta realicen sus funciones.

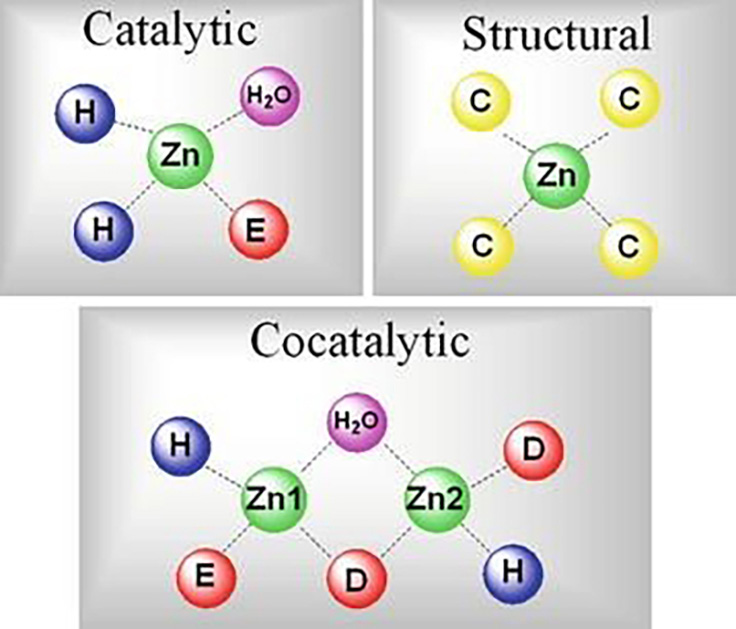
Figura 3. Representación de la organización del átomo zinc para realizar sus diferentes funciones. Tomada de https://link.springer.com/referenceworkentry/10.1007%2F978-1-4614-1533-6_182
Papel fisiológico del zinc
Como ya se mencionó, el ion de zinc tiene un papel catalítico, estructural y regulador muy importante. Está involucrado en muchos procesos biológicos como la homeostasis, que es el mantenimiento del equilibrio de todos los procesos biológicos. También en la respuesta inmune, en el estrés oxidativo, en la protección cuando el organismo se encuentra expuesto a metales tóxicos, en la apoptosis o muerte celular programada y en el envejecimiento.
La homeostasis de este metal está relacionada con cambios en la absorción y secreción de zinc, excreción urinaria y su distribución en tejidos y células. Para la absorción hay dos posibilidades dependiendo de varios factores, incluida la cantidad de zinc, el tipo de alimento consumido y los requerimientos corporales. Si la ingesta de zinc es baja, la absorción se lleva a cabo principalmente mediante un proceso mediado por transportadores que son secretados por el páncreas. En la luz intestinal el zinc proviene de dos fuentes: la dieta y los jugos digestivos. La presencia de ácido fítico, calcio y metales traza como el cadmio, el mercurio o el cobre, retarda su absorción, pero la presencia de glucosa en la luz intestinal ayuda a su absorción. Lo más probable es que la absorción se produzca mediante difusión pasiva y procesos mediados por el transportador para este metal, aumentando la entrada de zinc en relación con los requerimientos del cuerpo. Algunas enfermedades pueden causar una mala absorción de este metal tal como el síndrome de intestino corto, enfermedad celíaca, enfermedad de Crohn, VIH y fístulas enterocutáneas.
Debido a que el zinc no se almacena en el cuerpo este se puede excretar de diferentes maneras, incluidos los intestinos, los riñones, el integumento y el semen. Aunque la ruta principal de excreción es el intestino también pierden pequeñas cantidades de zinc en la orina, la piel descamada, el crecimiento del cabello, el semen y la menstruación. En comparación con todos los órganos, el cerebro contiene los niveles más altos de zinc en el cuerpo con una posible excepción de los islotes β pancreáticos. El nivel más alto de este elemento en el cerebro se encuentra en la materia gris del cerebro anterior, llegando a 60-90 partes por millón. Aproximadamente el 80% del zinc cerebral total existe como metaloproteínas de zinc, mientras que el resto existe principalmente en vesículas presinápticas, los altos niveles de zinc sináptico están presentes principalmente en los sistemas límbicos que son los encargados de regular las respuestas fisiológicas y emocionales de nuestro cuerpo.
El zinc y la salud
Tanto la deficiencia como el exceso de zinc pueden causar severos problemas en la salud. Por ejemplo, entre los síntomas de deficiencia temporal podemos encontrar: infecciones frecuentes, hipogonadismo en hombres, pérdida de cabello, pérdida de apetito, problemas en el sentido del gusto y olfato, llagas en la piel, crecimiento lento dificultad para ver en la oscuridad y heridas que tardan mucho en sanar. Mientras que los síntomas en caso de intoxicación debido a la ingesta de un exceso de zinc son: diarrea, cólicos abdominales y vómito en un lapso de 3 a 10 horas después de la ingestión. Aunque los síntomas desaparecen poco tiempo después de suspender la ingesta puede generar una deficiencia de cobre o hierro.
La deficiencia prolongada de zinc genera los estados patológicos más significativos que involucran un metal en el cuerpo humano. El riesgo de deficiencia de zinc afecta aproximadamente al 50% de la población mundial debido a que existen poblaciones cuyas dietas contienen altas concentraciones de fitato, que es un poderoso quelante. Es decir, un quelante es un compuesto que puede pegar, en este caso, al zinc. Se da este efecto, debido a que ciertas dietas son a base de muchos cereales y bajas en proteínas de origen animal. Los sistemas de órganos que se conocen clínicamente como afectados por una deficiencia severa de zinc incluyen los sistemas nervioso central, gastrointestinal, inmune, epidérmico, reproductivo y esquelético. La deficiencia de zinc puede provocar la muerte de niños con acrodermatitis enteropática, una enfermedad hereditaria por deficiencia de zinc que se manifiesta por calvicie, piel ulcerada e hipertrófica, desgaste muscular, diarrea crónica y genera infecciones recurrentes causadas por un recuento bajo de linfocitos debido a la atrofia.
El zinc también tiene un papel muy importante en el desarrollo de las enfermedades cardiovasculares, debido a que participa en la formación de las células del corazón y por lo tanto una deficiencia materna de este elemento puede causar problemas en el desarrollo. Por otro lado, también se ha documentado que participa en el mantenimiento de la presión arterial, así como en el desarrollo de la aterosclerosis. También se ha descrito que tiene un papel importante en el desarrollo de la diabetes tipo 2, ya que participa en la síntesis, almacenamiento y secreción de la insulina y la disminución de los niveles de zinc afecta negativamente la producción de insulina. Finalmente, un campo que todavía está en estudio es la participación del zinc en las enfermedades mentales como la depresión y el Alzheimer.
Si bien desde hace varios años se estudia la importancia del zinc en nuestra salud, aún hay muchas cosas por descubrir, por lo que como siempre en esta columna invitamos a los lectores a apoyar la ciencia tanto básica como aplicada para que podamos beneficiarnos de los avances científicos.
El 2019 ha sido propuesto por la Organización de las Naciones Unidas como el Año Internacional de la Tabla Periódica de los Elementos por lo que la Academia de Ciencias de Morelos ha decidido dedicarle una serie de artículos preparados por especialistas de diferentes disciplinas. Sirva este artículo para despertar su curiosidad y que nos permitan compartir con ustedes nuestro amor por los elementos y su máxima representación, la Tabla Periódica.
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos. Desde la Academia de Ciencias de Morelos externamos nuestra preocupación por el vacío que genera la extinción de la Secretaría de Innovación, Ciencia y Tecnología dentro del ecosistema de innovación estatal que se debilita sin la participación del Gobierno del Estado.
Ligas de interés
https://es.wikipedia.org/wiki/Zinc
https://www.quiminet.com/articulos/conozca-los-usos-y-aplicaciones-del-zinc-en-las-industrias-3374559.htm
https://medlineplus.gov/spanish/ency/article/002416.htm












 Desarrollado por Linabat
Desarrollado por Linabat